题目内容
【题目】某工厂排放的工业废水中含有大量硫酸铜、硫酸亚铁、硫酸锌.某环保小组设计了一个回收金属铜、铁与硫酸锌晶体的实验方案,流程如下图:

(1)操作Ⅰ的名称是 ,固体F的化学式为 .
(2)固体D加入适量X溶液后,发生反应的化学方程式为 .
(3)若步骤①加入锌粉的质量不足,则下列滤液B中所含溶质的猜想,不正确的是 (填序号).
A.ZnSO4、FeSO4 B.ZnSO4、CuSO4
C.ZnSO4、FeSO4、CuSO4 D.FeSO4、CuSO4.
【答案】(1)磁铁吸引,Cu;(2)Zn+H2SO4═ZnSO4+H2↑;(3)BD.
【解析】由题意实验方案可知,向一定量的工业废水中加入过量的锌粉,锌先与硫酸铜反应生成了硫酸锌和铜,当硫酸铜反应完后,再与硫酸亚铁反应生成了硫酸锌和铁,利用铁能磁铁吸附可以将铁分离出来,过量的锌再用适量的稀硫酸除去,这样就得到了铜和硫酸锌溶液.
(1)由上述分析可知,固体A是银、铜、锌的混合物,利用铁能被磁铁吸附可以将铁分离出来,得到固体C是铁,所以,操作Ⅰ的名称是磁铁吸引;固体D是铜和锌的混合物,过量的锌再加入适量的硫酸除去,得到了固体F是铜,化学式为Cu;
(2)由上述分析可知,固体D加入适量X溶液后,发生的反应是锌与硫酸的反应,化学方程式为:Zn+H2SO4═ZnSO4+H2↑.
(3)A.当加入的锌不足,不能将硫酸亚铁置换出来,溶液的溶质是ZnSO4、FeSO4,故A正确;
B.由于铁比铜活泼,若溶液中含有硫酸铜就一定含有硫酸亚铁,故B错误;
C.当加入的锌不足,不能将硫酸铜全部置换出来,则溶液中一定含有ZnSO4、FeSO4、CuSO4,故C正确;
D.由于锌参加了反应,溶液中一定含有硫酸锌,故D错误.

【题目】右图所示,某河旁甲、乙、丙、丁四座化工厂排放的工业废水中分别含有碳酸钠、氯化铜、氢氧化钠、盐酸中的一种.某同学对①、②、③、④处水质监测时记录了以下现象.根据现象推断,甲、乙、丙、丁四座化工厂排放工业废水的成分,错误的是( )
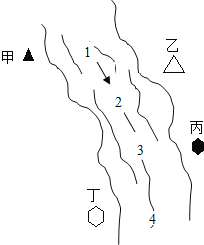
① | ② | ③ | ④ | |
记录现象 | 无色溶液 | 蓝色浑浊 | 浑浊消失 | 产生气泡 |
A.甲:碳酸钠 B.乙:氯化铜 C.丙:盐酸 D.丁:碳酸钠