题目内容
【题目】(7分)某实验小组利用图1所示仪器配制一定溶质质量分数的氯化钠溶液。
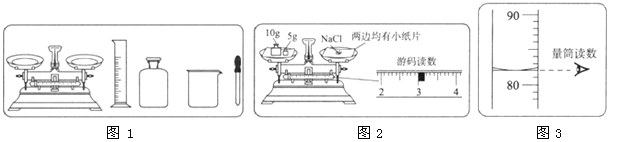
(1)图1中缺少一种必须用到的玻璃仪器,它是
(2)图2中的操作错误是 ;若按图2操作,取用的氯化钠实际质量为 g。
(3)量取蒸馏水的体积读数如图3所示,则该实验小组原计划配制的氯化钠溶液的溶质质量分数为(水的密度为1 g/cm3) ,而实际得到溶液的溶质质量分数为
(4)在上述实际配得的溶液中加6.0g水,则溶液的溶质质量分数为
(5)在上述实际配得的溶液中加23.0g氯化钠,则溶液的溶质质量分数为 (已知:25℃时,氯化钠的溶解度是36g。计算结果均保留一位小数)
【答案】(1)玻璃棒 (2)砝码应放在右边,氯化钠应放在左边 12.0g (3)18% 12.8%
(4)12.0% (5)26.5%
【解析】
试题分析:(1)配制溶液的一般步骤是:计算、称量、溶解,溶解时要用到玻璃棒,作用是搅拌;
(2)托盘天平的使用是左物右码,即砝码应放在右边,氯化钠应放在左边;操作错误时,物体的质量=砝码的质量-游码的质量,即氯化钠的质量=15g-3g=12g;
(3)由图3可知水的体积为82ml,那么水的质量为82g,故该实验小组原计划配制的氯化钠溶液的溶质质量分数=18g/100g ×100%=18%,实际配的的氯化钠溶液的质量分数=12g/(12g+82g)×100%=12.8%;
(4)溶液的稀释过程中溶质的质量不变,故溶液的质量分数=12g/(94g+6g)×100%=12%;
(5)25℃时,氯化钠的溶解度是36g,那么82g水中最多溶解的氯化钠的质量为36g/100g =a/82g,a=29.52g,即加入的氯化钠不能完全溶解,所得溶液的溶质质量分数=
29.52g/(29.52g+82g)×100%=26.5% 。