题目内容
【题目】将一定质量的金属锌投入到100g稀硫酸中恰好完全反应,放出气体的质量与反应时间的关系如图所示,试求:
(1)完全反应后生成H2的质量为_____g;
(2)所用硫酸溶液中溶质的质量分数____?(结构精确到0.1%)
(3)所得溶液中溶质的质量分数?(结构精确到0.1%)
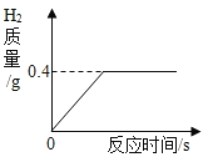
【答案】0.4 19.6%
【解析】
锌和稀硫酸反应生成硫酸锌和氢气,根据氢气质量可以计算硫酸质量和反应生成的硫酸锌质量,进一步可以计算所用硫酸溶液中溶质的质量分数、所得溶液中溶质的质量分数。
解:(1)由图中信息可知,完全反应后生成H2的质量为0.4g;
(2)设锌质量为x,硫酸质量为y,生成硫酸锌质量为z,

![]() x=13g,
x=13g,
![]() y=19.6g,
y=19.6g,
![]() z=32.2g,
z=32.2g,
所用硫酸溶液中溶质的质量分数为:![]() ×100%=19.6%,
×100%=19.6%,
(3)所得溶液中溶质的质量分数为:![]() ×100%=28.6%。
×100%=28.6%。

练习册系列答案
相关题目