题目内容
【题目】实验室有一瓶标签被腐蚀的盐酸,小丽为了测定溶液中溶质的质量分数,在烧杯中配制了8g 10%的NaOH溶液。然后往烧杯中滴加该盐酸。反应过程中溶液的pH与滴入盐酸的质量关系如图所示。请回答下列问题:
(1)配制了8g 10%的NaOH溶液,需要水的质量为多少g;
(2)计算该盐酸的溶质质量分数;(写出计算过程)

(3)当滴入4g盐酸时,烧杯内溶液中钠元素的质量为多少g。
【答案】(1)7.2g
(2)解:设10g稀盐酸中氯化氢的质量为x。
NaOH+HCl===NaCl+H2O
40 36.5
8g×10% x
![]() =
=![]() x=0.73g
x=0.73g
该盐酸的溶质质量分数为x=![]() ×100%=7.3%。
×100%=7.3%。
答:该盐酸的溶质质量分数为7.3%。
(3)0.46g
【解析】(1)配制了8g 10%的NaOH溶液,需要水的质量为8g -8g× 10%=7.2g。
(2)解:设10g稀盐酸中氯化氢的质量为x。
NaOH+HCl = NaCl+H2O
40 36.5
8g×10% x
![]() =
=![]() ,x=0.73g
,x=0.73g
该盐酸的溶质质量分数为x=![]() ×100%=7.3%。
×100%=7.3%。
(3)当滴入4g盐酸时,烧杯内溶液中钠元素的质量为∶8g ×10%×![]() ×%=0.46g。
×%=0.46g。
答∶(1)配制了8g 10%的NaOH溶液,需要水的质量为7.2g。(2)该盐酸的溶质质量分数是7.3%。
(3)当滴入4g盐酸时,烧杯内溶液中钠元素的质量为0.46g。
点睛∶这是一道结合图像的综合计算题,溶液由溶质和溶剂组成,正确书写化学方程式是正确解决这道题的关键所在。灵活应用质量守恒定律是解决本题的有效方法。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,小鸣和同学们通过测定反应后溶液的pH,得到了如图所示的pH曲线,请回答:
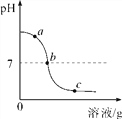
(1)由图可知该实验操作是将____________滴加到另一种溶液中;
(2)该反应的化学方程式为________________________________;
(3)实验过程中,小鸣取了a、b、c三处反应后的溶液于三个烧杯中,却忘了做标记,他设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液。
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3===CaCO3↓+2NaCl。
【探究过程】①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现____________________________的现象。结论:该样品是a处溶液。
②为进一步确定b或c处溶液,又设计了以下方案:
实验步骤 | 实验现象 | 实验结论 |
另取余下样品少量于两支试管中,分别滴加足量的Na2CO3溶液 | ||
__________________ | 该样品为b处溶液 | |
先有____________产生,后有____________产生 | 该样品为c处溶液,并推知溶液中的阳离子有________________ |
【反思评价】探究反应后溶液中溶质的成分,除了要考虑生成物之外,还要考虑________________________________。


