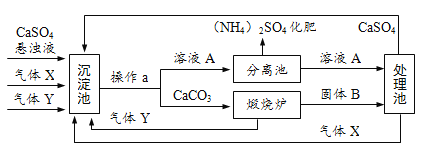
题目内容
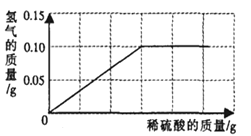
【题目】为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止。反应过程中生成的气体与所用硫酸溶液的质量关系如右图所示。试计算:
(1)样品中铜的质量分数;
(2)反应所消耗硫酸溶液质量;
(3)反应后所得溶液中溶质的质量分数。
【答案】(1)67.5%(2)50g(3)15.1%
【解析】
试题分析:根据图像可知,最终生成氢气的质量为0.10g,利用化学方程式进行计算即可。具体步骤如下:
解:根据图像知,氢气的质量=0.10g
设样品中锌的质量为X,,反应消耗硫酸质量为Y,反应后生成硫酸锌质量为M
Zn + H2SO4=ZnSO4 + H2↑
65 98 161 2
X Y M 0.10g
65/2=X/0.10g X=3.25g
98/2=Y/0.10g Y=4.9g
161/2=M/0.10g M=8.05g
则样品中铜的质量分数=(10g-3.25g)/10g×100%=67.5%
硫酸溶液的质量=4.9g÷9.8%=50g
反应后所得硫酸锌的质量分数=8.05g/(3.25g+50g-0.10g) ×100%=15.1%
答:略

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】下列叙述I和II都正确且有因果关系的是
选项 | 叙述I | 叙述II |
A | 碳具有还原性 | 焦炭可以还原四氧化三铁 |
B | 分子之间有间隔 | 浓氨水和浓盐酸接近时“空中生烟” |
C | 人体碘元素摄入量不足 | 易患有骨质疏松症 |
D | 二氧化碳不支持燃烧 | 二氧化碳能使澄清石灰水变浑浊 |