题目内容
【题目】同学们从攀枝花大黑山上采集到一种石灰石矿石.为测定其中碳酸钙的含量,他们取120g这种矿石样品进行煅烧(所含杂质不反应),充分反应后测得剩余固体的质量为87g.
(1)煅烧过程中生成CO2的质量为g;
(2)该矿石中碳酸钙的质量分数为 .
【答案】
(1)33
(2)62.5%
【解析】解:由题意知,二氧化碳的质量为120﹣87=33g, 设生成33g二氧化碳需要碳酸钙的质量为x,
CaCO3 | CO2↑ |
100 | 44 |
x | 33g |
![]()
x=75g
矿石中碳酸钙的质量分数为 ![]() =62.5%
=62.5%
答:煅烧过程中生成CO2的质量为33g,矿石中碳酸钙的质量分数为62.5%
由煅烧后得剩余固体的质量为87g,可得到生成二氧化碳的质量为120﹣87=33g,利用化学方程式根据33g二氧化碳可求出碳酸钙的质量,从而求出碳酸钙的质量分数.

练习册系列答案
相关题目
【题目】己知汽车尾气中的氮氧化物(以NOx表示)是氮气与氧气在高温下反应产生的.氮氧化物(NOx)等气体破坏人类生存的环境.稀薄燃烧发动机具有高效、经济、环保等优点,和普通汽车发动机对比如下:
发动机类型 | 发动机混合气中汽油与空气的质量比 | 发动机运转的温度 | 尾气中CO的含量 | 尾气中NOx的含量 |
普通发动机 | 1:15 | 较高 | 较高 | 较高 |
稀薄燃烧发动机 | 1:40 | 较低 | 较低 | 较低 |
汽车尾气净化装置里装有Pd等催化剂,气体在催化剂表面作用的机理如图所示.结合以上信息得出的下列结论中,不正确的是( )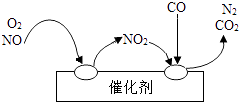
A.“稀薄”的含义是指发动机混合气中的汽油含量低
B.稀薄燃烧发动机尾气中NOx含量减少可能是因为温度低
C.稀薄燃烧发动机产生的尾气中CO含量减少是因为燃烧不充分
D.尾气净化装置中发生总反应的化学方程式为2NO+O2 +4CO ![]() ?N2 +4CO2
?N2 +4CO2

