题目内容
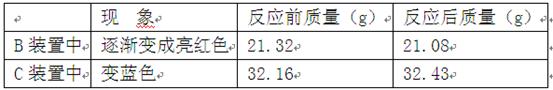
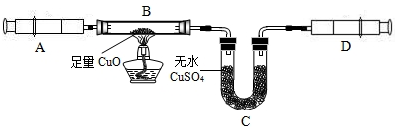
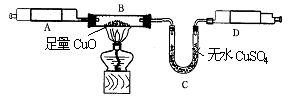
某校化学兴趣小组承担了某项研究课题的一部分:通过实验探究气体X(已知由两种元素组成)的元素组成.实验装置如下.将0.17gX气体由注射器A缓缓送入B装置(B装置中的空气已预先除去),使之完全反应,生成的气体全部用D装置抽取收集.实验的现象和数据记录如下: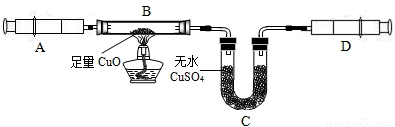
| 现 象 | 反应前质量(g) | 反应后质量(g) | |
| B装置中 | 逐渐变成亮红色 | 21.32 | 21.08 |
| C装置中 | 变蓝色 | 32.16 | 32.43 |
(2)经测定,D中的气体由一种元素组成,常温常压下密度是1.25g/L,试推测该气体的化学式是______,其质量是______g.(常见气体密度如下)
| 气 体 | H2 | O2 | CO | CH4 | N2 | CO2 |
| 常温常压时的密度(g/L) | 0.09 | 1.43 | 1.25 | 0.72 | 1.25 | 1.98 |
(2)利用表中所给气体的密度与所测定的气体D的密度相对比,并由D中的气体由一种元素组成,完成对气体D的判断;根据质量守恒定律,由反应前后物质总质量差可计算生成的气体D的质量;
(3)根据对反应的分析,确定反应的反应物与生成物,根据化学方程式书原则及方法,完成化学方程式的书写.
解答:解:(1)根据质量守恒定律,参加反应的氧元素的质量=21.32g-21.08g=0.24g;无水硫酸铜吸收了水装置C变蓝,说明气体X与氧化铜反应生成了水,根据反应前后元素不变,可判断气体X中含有氢元素;
(2)表中有两种气体CO和N2的密度都与气体D的常温常压下密度密度1.25g/L相同,若气体X为CO,与气体D中的气体由一种元素组成的测定结果相矛盾,因此可确定气体D为N2;根据质量守恒定律,生成D气体N2的质量=0.17g+21.32g+32.16g-21.08g-32.43g=0.14g;
(3)根据反应前后元素种类、质量都不变,及气体X由两种元素组成,可判断气体X是由N、H两元素组成的气体化合物,该气体中N、H元素的质量比=0.14g:(32.43-32.16-0.24)g=14:3,则N、H元素的原子个数比=
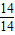 :
: =1:3,气体X的化学式可表示为NH3;
=1:3,气体X的化学式可表示为NH3;综合以上分析,装置B中反应为NH3与CuO在加热条件下发生反应,生成红色Cu、H2O和气体N2,反应的化学方程式为2NH3+3CuO
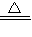 3Cu+3H2O+N2;
3Cu+3H2O+N2;故答案为:(1)0.24;氢;(2)N2;0.14;(3)2NH3+3CuO
 3Cu+3H2O+N2.
3Cu+3H2O+N2.点评:本题涉及到较多的基础知识和基本的理论和规律,需要具有较强的分析及运算推理的能力.

| 现 象 | 反应前质量(g) | 反应后质量(g) | |
| B装置中 | 逐渐变成亮红色 | 21.32 | 21.08 |
| C装置中 | 变蓝色 | 32.16 | 32.43 |
(2)经测定,D中的气体由一种元素组成,常温常压下密度是1.25g/L,试推测该气体的化学式是
| 气 体 | H2 | O2 | CO | CH4 | N2 | CO2 |
| 常温常压时的密度(g/L) | 0.09 | 1.43 | 1.25 | 0.72 | 1.25 | 1.98 |

| 现 象 | 反应前质量(g) | 反应后质量(g) | |
| B装置中 | 逐渐变成亮红色 | 21.32 | 21.08 |
| C装置中 | 变蓝色 | 32.16 | 32.43 |
(2)经测定,D中的气体由一种元素组成,常温常压下密度是1.25g/L,试推测该气体的化学式是______,其质量是______g.(常见气体密度如下)
| 气 体 | H2 | O2 | CO | CH4 | N2 | CO2 |
| 常温常压时的密度(g/L) | 0.09 | 1.43 | 1.25 | 0.72 | 1.25 | 1.98 |
某校化学兴趣小组承担了某项研究课题的一部分:通过实验探究一种气体X(已知由两种元素组成)的元素组成。实验装置如下。将0.17gX气体由注射器A缓缓送入B装置(B装置中的空气已预先除去),使之完全反应,生成的气体全部用D装置抽取收集。实验的现象和数据记录如下:
| 现 象 | 反应前质量(g) | 反应后质量(g) | |
| B装置中 | 逐渐变成亮红色 | 21.32 | 21.08 |
| C装置中 | 变蓝色 | 32.16 | 32.43 |
(1)参加反应的氧元素的质量是 g,X中一定有 元素。
(2)经测定,D中的气体由一种元素组成,常温常压下密度是1.25g/L,试推测该气体的化学式是 ,其质量是 g。(常见气体密度如下)
(3)(2分)写出B装置中发生反应的化学方程式 。
| 气 体 | H2 | O2 | CO | CH4 | N2 | CO2 |
| 常温常压时的密度(g/L) | 0.09 | 1.43 | 1.25 | 0.72 | 1.25 | 1.98 |
某校化学兴趣小组承担了某项研究课题的一部分:通过实验探究气体X(已知由两种元素组成,不含氧元素)的元素组成。实验装置如下,将0.17 g X气体由注射器A缓缓送入B装置(B装置中的空气已预先除去),使之完全反应,生成的气体全部用D装置抽取收集。实验的现象和数据记录如下:

| 现象 | 反应前质量(g) | 反应后质量(g) | |
| B装置中 | 逐渐变 成亮红色 | 21.32 | 21.08 |
| C装置中 | 变蓝色 | 32.16 | 32.43 |
(1)参加反应的氧元素的质量是________ g,X中一定有__________元素。
(2)经测定,D中的气体由一种元素组成,常温常压下密度是1.25 g/L,试推测该气体的化学式是_ _______,其质量是________ g。(常见气体密度如下)
_______,其质量是________ g。(常见气体密度如下)
| 气体 | H2 | O2 | CO | CH4 | N2 | CO2 |
|
| 0.09 | 1.43 | 1.25 | 0.72 | 1.25 | 1.98 |
(3)写出B装置中发生反应的化学方程式_________________________________。