题目内容
湛江海洋资源丰富,海水经过晒盐后得到粗盐和苦卤,重结晶后的食盐中还含有硫酸钠、氯化镁、氯化钙等可溶性杂质,他们在溶液中主要以SO42-、Ca2+、Mg2+的形式存在,为将这些杂质离子除净,应加入过量的氯化钡、氢氧化钠、碳酸钠等物质将其转化为沉淀,经过操作A除去;再加入适量的盐酸,得到精盐水,最后经蒸发即得精盐.以下是湛江某化工厂对海水进行综合利用的示意图:
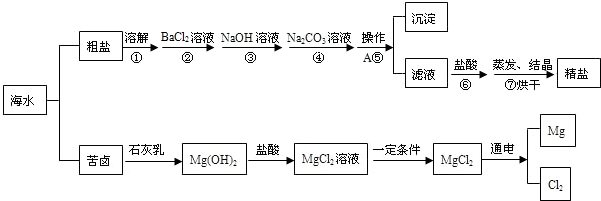
(1)写出杂质氯化镁转化为沉淀的化学方程式______;粗盐提纯中第⑤步操作A的名称是______.
(2)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是______;
(3)氢氧化镁也能治疗胃酸过多,请写出氢氧化镁中和胃酸的化学方程式______.
解:(1)根据图示将氯化镁转换为沉淀是加入试剂氢氧化钠,方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;通常将不溶物除去的方法是过滤.
故填:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;过滤
(2)经过前五步后,因为加入过量的碳酸钠、氢氧化钠溶液,仍存在于滤液中,根据实验目的要制备精盐,所以加入过量盐酸可以将碳酸根变为二氧化碳其它除去,将氢氧根变为水除去.
故答案为:除去多余的氢氧化钠和碳酸钠
(3)氢氧化镁是一种碱,根据碱的性质可知可以和盐酸发生中和反应生成盐和水,Mg(OH)2+2HCl=MgCl2+2H2O.
故答案为:Mg(OH)2+2HCl=MgCl2+2H2O
分析:首先分析操作过程:向含有SO42-、Ca2+、Mg2+的粗盐中,加入过量的氯化钡可将除去、继续加过量的氢氧化钠可以将离子转换为沉淀、继续加入过量的碳酸钠可以将加入过量的钡离子除去,经过过滤操作将沉淀除去;再加入适量的盐酸,可将过量的碳酸根、氢氧根除去.其次书写化学方程式要根据书写要求进行书写,注意化学式的正确书写、配平、标物质的符号等.
点评:本题阅读量比较大,要排除干扰信息,抓住解题的实质,快速解答.同时通过本题要总结海水制备精盐的方法.
故填:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;过滤
(2)经过前五步后,因为加入过量的碳酸钠、氢氧化钠溶液,仍存在于滤液中,根据实验目的要制备精盐,所以加入过量盐酸可以将碳酸根变为二氧化碳其它除去,将氢氧根变为水除去.
故答案为:除去多余的氢氧化钠和碳酸钠
(3)氢氧化镁是一种碱,根据碱的性质可知可以和盐酸发生中和反应生成盐和水,Mg(OH)2+2HCl=MgCl2+2H2O.
故答案为:Mg(OH)2+2HCl=MgCl2+2H2O
分析:首先分析操作过程:向含有SO42-、Ca2+、Mg2+的粗盐中,加入过量的氯化钡可将除去、继续加过量的氢氧化钠可以将离子转换为沉淀、继续加入过量的碳酸钠可以将加入过量的钡离子除去,经过过滤操作将沉淀除去;再加入适量的盐酸,可将过量的碳酸根、氢氧根除去.其次书写化学方程式要根据书写要求进行书写,注意化学式的正确书写、配平、标物质的符号等.
点评:本题阅读量比较大,要排除干扰信息,抓住解题的实质,快速解答.同时通过本题要总结海水制备精盐的方法.

练习册系列答案
相关题目

 20、湛江海洋资源十分丰富.随着科学技术的不断发展,不仅可以通过高分子材料来淡化海水,还可以从海水中提取食盐、金属镁等重要的化学物质.
20、湛江海洋资源十分丰富.随着科学技术的不断发展,不仅可以通过高分子材料来淡化海水,还可以从海水中提取食盐、金属镁等重要的化学物质.