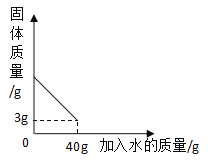
题目内容
【题目】用如图所示的装置进行实验.

(1)实验1:观察到棉花团均变红。该实验可证明分子具有的性质是___________。能说明氨气密度比空气小的现象是________________。
(2)实验2:发生反应的化学方程式为_____________。实验中,观察到U型管中液面a低于液面b,其原因是___________。
【答案】分子在不断运动 ①比③先变红 Mg+2HCl=MgCl2+H2↑ 镁和稀盐酸反应放热,使装置内压强增大,从而导致U型管左低右高
【解析】
(1)三处滴有酚酞的棉花均变红,说明液氨中的氨分子在不断运动,当遇到酚酞溶液时,氨分子与水分子结合形成氨水,氨水显碱性,所以使酚酞变红。因为氨气分子的密度比空气小,所以氨气会向上挥发,优先与②、①接触,使②、①处的棉花变红,等氨气充满导管后,才与最下方的③接触,使③变红。故答案为:分子在不断运动、①比③先变红;
(2)镁和盐酸反应生成氯化镁和氢气。该反应会放出热量,使装置内的气体受热膨胀,增大压强,从而导致U型管的a液面低于b液面。故答案为:Mg+2HCl=MgCl2+H2↑、镁和稀盐酸反应放热,使装置内压强增大,从而导致U型管左低右高。

 金博士一点全通系列答案
金博士一点全通系列答案【题目】下列四个实验,根据实验现象得出的结论,正确的是 。
|
|
|
|
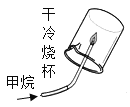
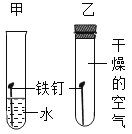
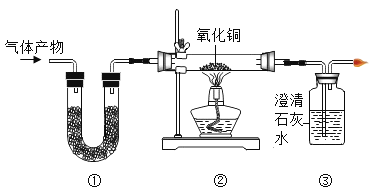
A.可燃物燃烧除需O2,还需温度达到着火点 | B.CO2与H2O反应生成 H2CO3 | C.CH4燃烧生成CO2和H2O | D.铁钉生锈只需与H2O接触 |
A.AB.BC.CD.D
【题目】归纳、整理是学习化学的有效方法。下列选项正确的是
A.认识化学式 “珍惜生命,远离毒品” 某毒品化学式为C12H19O2N,该物质由四种元素组成;该物质由33个原子构成 | B.性质决定用途 石墨具有良好的导电性——可作电极,氧气具有助燃性——可作燃料 |
C.理解化学方程式 2H2O | D.化学与能源 化石燃料属于不可再生能源; 太阳能、风能、氢能属于清洁能源 |
A. AB. BC. CD. D