题目内容
称取NaCl和BaCl2的固体混合物32.5g,加入100g蒸馏水,完全溶解后向该混合溶液中逐滴加入质量分数为10%的Na2SO4溶液,反应生成BaSO4沉淀的质量与所加入的Na2SO4溶液的质量关系如下图所示。试回答下列问题:
(提示:BaCl2+Na2SO4=BaSO4↓+2NaCl)
(1)完全反应后生成BaSO4沉淀 72 g。(1分)
(2)恰好完全反应时消耗Na2SO4溶液的质量是 73 g。(2分)
(3)恰好完全反应时所得溶液中溶质的质量分数是多少?(精确到0.1%) 74 (3分)
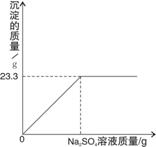
72. 23.3 (1分) 73. 142 (2分)
74.解:设BaCl2 的质量为x,反应生成的NaCl的质量为y。
BaCl2+Na2SO4 =BaSO4↓+2NaCl
208 233 117
![]() 23.3g y
23.3g y
![]()
![]() =20.8g
=20.8g ![]() =11.7g……1分
=11.7g……1分
恰好完全反应时,溶液中NaCl的质量为11.7g+(32.5g-20.8g)=23.4g……1分
NaCl 溶液溶质的质量分数![]() =9.3%……1分
=9.3%……1分

练习册系列答案
相关题目
 (2013?庆阳)称取NaCl和BaCl2的固体混合物32、5g,加入100g蒸馏水,完全溶解后向该混合溶液中逐滴加入质量分数为10%的Na2SO4溶液,反应生成BaSO4沉淀的质量与所加入的Na2SO4溶液的质量关系如图所示.试回答下列问题:(提示:BaCl2+Na2SO4═BaSO4↓+2NaCl)
(2013?庆阳)称取NaCl和BaCl2的固体混合物32、5g,加入100g蒸馏水,完全溶解后向该混合溶液中逐滴加入质量分数为10%的Na2SO4溶液,反应生成BaSO4沉淀的质量与所加入的Na2SO4溶液的质量关系如图所示.试回答下列问题:(提示:BaCl2+Na2SO4═BaSO4↓+2NaCl)


 (1)完全反应后生成BaSO4沉淀 g。(1分)
(1)完全反应后生成BaSO4沉淀 g。(1分) SO4溶液的质量是多少克?(2分)
SO4溶液的质量是多少克?(2分)