题目内容
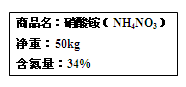
某化工有限公司生成的硝酸铵产品包装袋上的说明如图所示,(1)若你来计算硝酸铵的含氮量,你的方法是______.
(2)请你判断该化工有限公司生成的硝酸铵是纯净物还是混合物?______
(3)该化工有限公司生产一袋硝酸铵产品中氮元素的质量是______;多少kg尿素[CO(NH2)2]与一袋硝酸铵产品中含氮元素质量相同?(写出计算过程,结果精确到0.1%)

【答案】分析:(1)根据化学式判断原子个数,用原子个数、相对原子质量和相对分子质量来计算
(2)根据氮元素质量分数比较判断
(3)样品质量×含氮量得氮元素质量.用氮元素质量除以氮元素在尿素中的质量分数得尿素的质量.
解答:解:(1)根据化学式及元素质量分数的计算来计算,故答案为:根据化学式判断原子个数,用原子个数和原子量来计算,NH4NO3中有2个N原子,可列式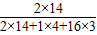 ×100%=
×100%=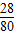 ×100%=35%;
×100%=35%;
(2)因为35%>34%,故该硝酸铵样品是混合物.
(3)由标签说明可知一袋样品是50kg,含氮量为34%,因此含氮元素质量为50kg×34%=17kg;尿素中氮元素的质量分数为:
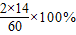 =46.7%,含氮量为17kg,需要尿素的质量为:
=46.7%,含氮量为17kg,需要尿素的质量为: =36.4kg
=36.4kg
故答案为:
(1)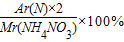 =
=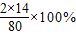 =35%.
=35%.
(2)混合物
(3)17kg; 36.4kg
点评:本题考查学生对信息的判断和使用,认识身边处处有化学知识,要学会用化学知识来解答生活中常见的化学问题.
(2)根据氮元素质量分数比较判断
(3)样品质量×含氮量得氮元素质量.用氮元素质量除以氮元素在尿素中的质量分数得尿素的质量.
解答:解:(1)根据化学式及元素质量分数的计算来计算,故答案为:根据化学式判断原子个数,用原子个数和原子量来计算,NH4NO3中有2个N原子,可列式
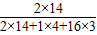 ×100%=
×100%=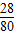 ×100%=35%;
×100%=35%;(2)因为35%>34%,故该硝酸铵样品是混合物.
(3)由标签说明可知一袋样品是50kg,含氮量为34%,因此含氮元素质量为50kg×34%=17kg;尿素中氮元素的质量分数为:
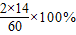 =46.7%,含氮量为17kg,需要尿素的质量为:
=46.7%,含氮量为17kg,需要尿素的质量为: =36.4kg
=36.4kg故答案为:
(1)
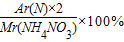 =
=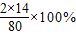 =35%.
=35%.(2)混合物
(3)17kg; 36.4kg
点评:本题考查学生对信息的判断和使用,认识身边处处有化学知识,要学会用化学知识来解答生活中常见的化学问题.

练习册系列答案
相关题目
 某化工有限公司生成的硝酸铵产品包装袋上的说明如图所示,
某化工有限公司生成的硝酸铵产品包装袋上的说明如图所示,