题目内容
【题目】叠氮化钠(NaN3)被广泛应用于汽车的安全气囊,其反应原理是在加热或撞击下NaN3迅速分解为金属钠和氮气。已知工业级NaN3样品中仅含有少量的Na2CO3,加热时Na2CO3不分解。现将14.0 g工业级NaN3样品在隔绝空气的环境中反复加热至恒重,发现样品质量减小了8.4 g。请计算:
(1)NaN3中钠元素与氮元素的质量比。______
(2)工业级NaN3样品中氮元素的质量分数。_____
(3)工业级NaN3样品中Na2CO3的质量分数。(计算结果精确到0.1%)_____
【答案】23:42 60% 7.1
【解析】
解: (1)NaN3中钠元素与氮元素的质量比:23:3×14=23:42;
(2)反应生成的N2质量为8.4g,即样品中氮元素的质量为8.4g,工业级NaN3样品中氮元素的质量分数:![]()
(3)设工业级样品中NaN3的质量为x
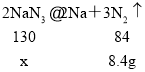
![]() x=13 g
x=13 g
工业级NaN3样品中Na2CO3的质量分数:![]()
答:(1)NaN3中钠元素与氮元素的质量比为23:42。
(2)工业级NaN3样品中氮元素的质量分数为60%。
(3)工业级NaN3样品中Na2CO3的质量分数为7.1%。

练习册系列答案
相关题目