题目内容
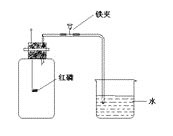
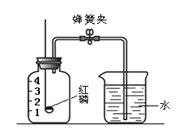
【题目】某化学兴趣小组为了粗略测定一批石灰石样品中CaCO3的质量分数,设计并进行如下实验。实验装置如图所示,称取研细的2.60g石灰石样品,分4次加入稀盐酸,充分反应至不再产生气体为止。测得反应前后的有关质量如表:
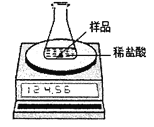

(1)计算石灰石样品中CaCO3的质量分数。
(2)若在上述实验过程中石灰石样品和所加酸液均无抛洒,根据图中装置判断,该实验结果可能 (填“偏大”、“偏小”或“准确”),原因是 。
【答案】(1)76.9%;(2)偏小;有二氧化碳溶解在水中或在容器中没有完全散逸出来。
【解析】
试题分析:据质量守恒定律可知,反应前后物质的总质量不变。故二氧化碳的=104.6g+20g-123.72g=0.88g,
石灰石样品中CaCO3的质量为x,则
CaCO3+2HCl==CaCl2+CO2↑+H2O
100 44
X 0.88g
100/x=44/0.88g得x=2g
石灰石样品中CaCO3的质量分数=2g÷2.60g×100%=76.9%;若在上述实验过程中石灰石样品和所加酸液均无抛洒,根据图中装置判断,该实验结果可能偏小,原因是有二氧化碳溶解在水中或在容器中没有完全散逸出来,使测定二氧化碳的质量偏小,导致计算的碳酸钙的质量分数偏小。

练习册系列答案
相关题目