题目内容
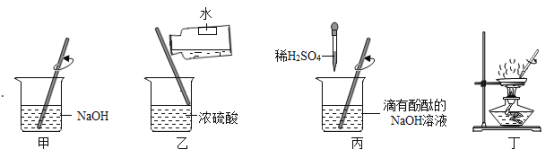
NaCl是重要的资源,其应用与生产如下图所示。下列说法不正确的是

A.应用①操作的主要步骤为:计算、称量、溶解、装瓶、贴标签
B.应用②在制备烧碱的过程中,水参与了反应
C.应用③为提高产率应先通NH3,再通CO2,制备过程中还能得到一种化肥
D.生产中提纯粗盐时可依次加入过量的BaCl2、NaOH、Na2CO3溶液,再过滤、蒸发
 阅读快车系列答案
阅读快车系列答案化学链燃烧是新的燃烧概念,即燃料不直接与空气接触燃烧,而是以载氧体(如CaSO4等)在两个反应器之间的循环来实现燃料的燃烧过程(如图1)。请回答下列问题:

(1)空气反应器中主要发生化合反应,化学方程式为_____。燃料反应器中, CO与CaSO4发生的反应方程式为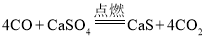 。
。
(2)实验室模拟CO与石膏(CaSO4﹒2H2O)的反应,并测定CO与石膏(CaSO4﹒2 H2O)是否反应完全,设计装置如图2。

①广口瓶B的作用是_____。C中反应的化学方程式为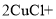 _____
_____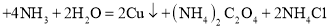 ,C装置的作用是_____,该实验的尾气无毒。
,C装置的作用是_____,该实验的尾气无毒。
②完成实验报告(已知:热的CaS会跟氧气反应;氯化亚铜和氨水混合溶液为无色)。
实验步骤 | 现象 | 分析与解释 |
检查气密性并装填好药品后,首先应先通一会CO | C中_____(填反应现象) | |
点燃A处酒精喷灯 | D中_____(填反应现象) | |
停止加热,继续通一会CO,直到装置冷却 | 继续通CO目的:(1)使生成的CO2全部被氢氧化钡溶液吸收; (2)_____ | |
取A中残留固体,加足量稀盐酸 | _____(填反应现象),有少量不溶物 |
|
(3)若所取石膏样品(CaSO4﹒2 H2O)质量为1.00g,装置D中产生的BaCO3的质量为3.94g,求石膏样品的转化率。_____(转化率: ,己知BaCO3的相对分子质量为197)(写出计算过程)
,己知BaCO3的相对分子质量为197)(写出计算过程)
(4)D装置中不宜使用澄清石灰水的理由是_____。


 ,石膏样品_____转化(选填“完全”或“不完全”)
,石膏样品_____转化(选填“完全”或“不完全”)