题目内容
人类的生产、生活离不开金属.
(1)用铜制电线主要是利用铜具有良好的________性.
(2)人们常用“铜墙铁壁”来形容物体的坚固.但铁在一定条件下也能发生各种反应,如铁丝在氧气中燃烧,反应的化学方程式是________.
(3)铁制品锈蚀,实际上是铁跟空气中的________发生了化学反应.防止铁制栏杆锈蚀的一种方法是________.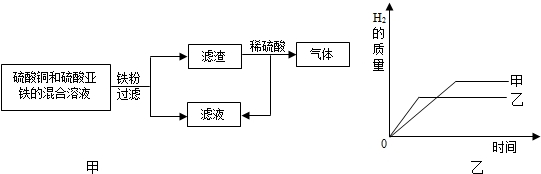
(4)根据如图甲所示回答:滤渣中一定有的金属是________,滤渣与稀硫酸反应的化学方程式为________.
(5)把某稀硫酸分为等体积的两份,放入两个烧杯中,分别加入等质量的锌、铁两种金属,反应后金属都没有剩余,产生氢气的质量随反应时间变化曲线如图乙.下列说法正确的是________.(填字母序号)
A.甲是铁,乙是锌
B.铁消耗硫酸的质量比锌大
C.参加反应的锌的质量小于铁的质量
D.充分反应后,稀硫酸一定都有剩余.
解:(1)铜具有良好的导电性,可以用于制造电线,故填:导电;
(2)铁在氧气燃烧生成四氧化三铁,故填:3Fe+2O2 Fe3O4;
Fe3O4;
(3)铁在有水和氧气并存的条件下易生锈,防止铁制栏杆生锈的方法可以在铁栏杆表面刷漆,故填:水和氧气,刷漆;
(4)在金属活动性顺序中,铁在铜的前面,铁能与硫酸铜溶液反应生成硫酸亚铁和铜,故滤渣中一定含有铜,在滤渣中加入稀硫酸有气泡产生,则一定含有铁,铁能与稀硫酸反应生成硫酸亚铁和氢气,故填:Fe和 Cu,Fe+H2SO4=FeSO4+H2↑;
(5)A、把某稀硫酸分为等体积的两份,放入两个烧杯中,分别加入等质量的锌、铁两种金属,反应后金属都没有剩余,说明金属全部参加反应,据图可以知道,在相同的时间内,乙产生的氢气质量比甲多,故乙是锌,甲是铁,故A正确;
B、
Fe+H2SO4=FeSO4+H2↑
56 98
设56份质量的锌消耗硫酸的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 98
56 x

x≈84
故相同质量的锌和铁,铁消耗稀硫酸的质量大,故B正确;
C、反应后金属都没有剩余,说明金属全部参加反应,故消耗的铁盒锌的质量相等,故C错误;
D、根据B选项计算可知道,充分反应后,铁消耗的硫酸的质量大于锌消耗的硫酸的质量,有可能是豫铁反应的硫酸恰好完全反应,故D错误;
故选AB.
分析:根据金属的有关性质进行分析,金属具有良好的导电性,铁在氧气中燃烧生成四氧化三铁,铁生锈实际上是铁与空气的氧气和水共同作用的结果,防锈就是破坏铁生锈的条件,在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,氢前的金属能与酸反应生成氢气.
点评:本题考查了金属的有关性质,完成此题,可以依据已有的知识进行.要求同学们熟练掌握金属与酸以及金属与盐溶液反应的知识,以便灵活应用.
(2)铁在氧气燃烧生成四氧化三铁,故填:3Fe+2O2
 Fe3O4;
Fe3O4;(3)铁在有水和氧气并存的条件下易生锈,防止铁制栏杆生锈的方法可以在铁栏杆表面刷漆,故填:水和氧气,刷漆;
(4)在金属活动性顺序中,铁在铜的前面,铁能与硫酸铜溶液反应生成硫酸亚铁和铜,故滤渣中一定含有铜,在滤渣中加入稀硫酸有气泡产生,则一定含有铁,铁能与稀硫酸反应生成硫酸亚铁和氢气,故填:Fe和 Cu,Fe+H2SO4=FeSO4+H2↑;
(5)A、把某稀硫酸分为等体积的两份,放入两个烧杯中,分别加入等质量的锌、铁两种金属,反应后金属都没有剩余,说明金属全部参加反应,据图可以知道,在相同的时间内,乙产生的氢气质量比甲多,故乙是锌,甲是铁,故A正确;
B、
Fe+H2SO4=FeSO4+H2↑
56 98
设56份质量的锌消耗硫酸的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 98
56 x

x≈84
故相同质量的锌和铁,铁消耗稀硫酸的质量大,故B正确;
C、反应后金属都没有剩余,说明金属全部参加反应,故消耗的铁盒锌的质量相等,故C错误;
D、根据B选项计算可知道,充分反应后,铁消耗的硫酸的质量大于锌消耗的硫酸的质量,有可能是豫铁反应的硫酸恰好完全反应,故D错误;
故选AB.
分析:根据金属的有关性质进行分析,金属具有良好的导电性,铁在氧气中燃烧生成四氧化三铁,铁生锈实际上是铁与空气的氧气和水共同作用的结果,防锈就是破坏铁生锈的条件,在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,氢前的金属能与酸反应生成氢气.
点评:本题考查了金属的有关性质,完成此题,可以依据已有的知识进行.要求同学们熟练掌握金属与酸以及金属与盐溶液反应的知识,以便灵活应用.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目