题目内容
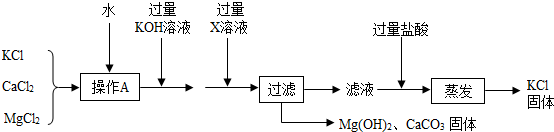
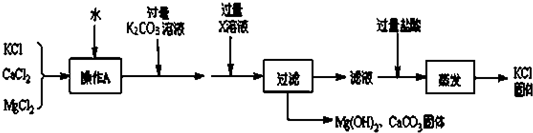
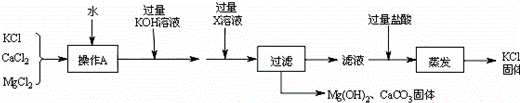
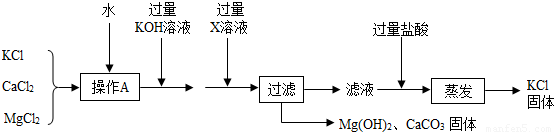
提纯某KCl样品(含有少量的MgCl2和K2SO4)的方案(所加试剂均过量)如下:
样品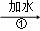 溶液
溶液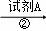 浊液
浊液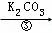 滤液
滤液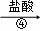 溶液
溶液
回答下列问题:
(1)步骤①和③的实验操作均用到的玻璃仪器有玻璃棒和 .
(2)步骤②得到的浊液中含有Mg(OH)2和BaSO4沉淀,写出生成BaSO4的化学方程式 .
(3)确定步骤③所加的K2CO3是否过量的方法是:在加入K2CO3后的浊液中取少量上层澄清液于试管,然后滴加K2CO3溶液,若没有白色沉淀生成,则说明所加K2CO3 .
(4)步骤④得到的溶液的溶质除了KCl外,还含有 (填化学式).若要得到KCl晶体,还要进行如下操作:将溶液倒入 (填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到 时(填现象),停止加热,用余热使水分蒸干.
试题分析:(1)溶解、过滤时都要用到玻璃棒和烧杯.
故填:烧杯.
(2)步骤②得到的浊液中含有Mg(OH)2和BaSO4沉淀,说明试剂A是氢氧化钡溶液,氢氧化钡和硫酸钾反应能生成硫酸钡沉淀和氢氧化钾,反应的化学方程式为:
Ba(OH)2+K2SO4═BaSO4↓+2KOH.
故填:Ba(OH)2+K2SO4═BaSO4↓+2KOH.
(3)在加入K2CO3后的浊液中取少量上层澄清液于试管,然后滴加K2CO3溶液,若没有白色沉淀生成,则说明所加碳酸钾过量.
故填:过量.
(4)步骤④得到的溶液的溶质除了KCl外,还含有盐酸,盐酸中的溶质是氯化氢,化学式是HCl.
故填:HCl.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目