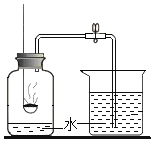
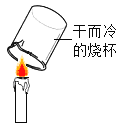
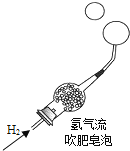
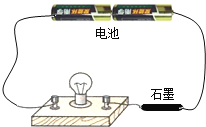
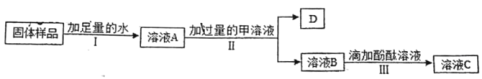
题目内容
硫酸镁晶体(MgSO4﹒7H2O)是一种重要的化工原料,可用作制革、炸药、造纸、瓷器等。以菱镁矿(主要成分是碳酸镁,含少量FeCO3和不溶于水、也不溶于酸的杂质)为原料制取硫酸镁晶体的流程如下:
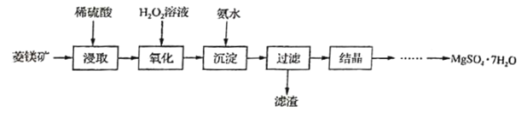
已知:部分氢氧化物沉淀时溶液的pH见下表:
物质名称 | Mg(OH)2 | Fe(OH)3 |
开始沉淀 | 9.1 | 1.9 |
完全沉淀 | 11.1 | 3.2 |
(1)“浸取”步骤中,MgCO3 溶于稀硫酸的化学方程式为_______。
(2)“氧化”步骤中,加入H2O2溶液会生成Fe2(SO4)3和水,该反应的化学方程式是_____________。
(3)“沉淀”步骤中,用氨水调节溶液的pH范围为_______,其目的是________。
(4)“过滤”所得滤液中含有的阳离子为_________(写离子符号)。
(5)“结晶”步骤中需蒸发浓缩滤液,当蒸发皿中_______时 即可停止加热。
 阅读快车系列答案
阅读快车系列答案下表是Ca(OH)2和NaOH的溶解度数据.请回答下列问题:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | ||||||
Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
NaOH | 31 | 91 | 111 | 129 | 313 | 336 |
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,图中能表示NaOH溶解度曲线的是_____(填“A”或“B”).
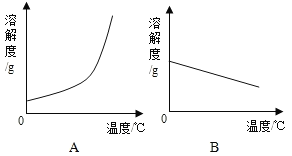
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,可采取措施有_____(填序号).
①蒸发水 ②升高温度 ③降低温度 ④加入水 ⑤加入氢氧化钙
(3)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是_____.
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后恢复20℃,得到乙溶液,溶液中溶质的质量分数的关系为甲_____乙(填“>”“<”或“=”).