题目内容
给29.4克氯酸钾和二氧化锰的混合物加热,测得剩余固体的质量(m)与反应时间(t)的关系如下表:
| 反应时间t∕s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| 反应后固体的质量m∕g | 29.4 | 27.4 | 25.4 | 23.4 | 21.4 | 19.8 | 19.8 |
(1)当氯酸钾完全反应后,生成氧气的质量为 g。
(2)剩余固体由哪些物质组成?它们的质量各为多少克?
(1) 9、6g (2) 剩余固体中有MnO2和KCl,,质量分别为:4.9g、14.9g。
解析试题分析:(1)根据质量守恒定律和化学方程式2KClO3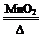 2KCl + 3O2 ↑可知,反应前后固体减少质量应为氧气的质量,29.4g-19.8g="9.6g;"
2KCl + 3O2 ↑可知,反应前后固体减少质量应为氧气的质量,29.4g-19.8g="9.6g;"
(2) 根据氧气的质量和化学方程式可进一步求出反应后生成氯化钾的质量。
解:设反应后生成的氯化钾质量为x
2KClO3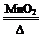 2KCl + 3O2 ↑
2KCl + 3O2 ↑
149 96
x 9.6g 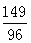 =
= x =
x =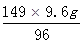 =14.9g
=14.9g
剩余固体中MnO2的质量19.8g-14.9g=4.9g
答:剩余固体中有MnO2和KCl,,质量分别为:4.9g、14.9g。
考点:质量守恒定律及其应用;有关化学方程式的计算。
点评:代入化学方程式中的物质质量必须为纯净物的质量。

给29.4克氯酸钾和二氧化锰的混合物加热,测得剩余固体的质量(m)与反应时间(t)的关系如下表:
| 反应时间t∕s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| 反应后固体的质量m∕g | 29.4 | 27.4 | 25.4 | 23. | 21.4 | 19.8 | 19. |
请回答下列问题:
(1)当氯酸钾完全反应后,生 成氧气的质量为 g。
成氧气的质量为 g。
(2)剩余固体由哪些物质组成?它们的质量各为多少克?
 4
4