题目内容
【题目】硬水受热后会产生水垢,水垢的主要成分是 CaCO3 和 Mg(OH)2。实验室由水垢制取纯净 CaCl2 固体的流程如下:(水垢中其它成分不参与反应),请按要求填空:
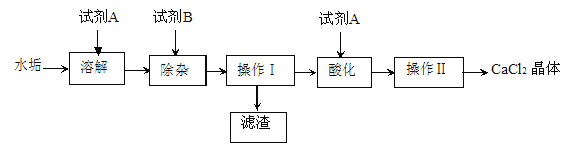
⑴ 试剂 A 的名称为_______________。
⑵ 试剂 B 的化学式是___________,若加入的试剂A、B都是过量的,则加入试剂 B 发生的非中和反应的化学反应方程式是_______________。操作Ⅰ的名称是__________,该操作中除用到玻璃仪器外,还需要的实验用品有_________。
⑶ 酸化过程加试剂 A 的作用__________________________。
⑷“操作Ⅱ”包含的操作有:蒸发浓缩、______________、过滤、洗涤、干燥等。
【答案】 盐酸(或氯化氢溶液) Ca(OH)2 Ca(OH)2 + MgCl2 === Mg(OH)2↓+ CaCl2 过滤 铁架台(带铁圈)和滤纸 除去过量的Ca(OH)2(或除去OH-) 降温结晶
【解析】(1)水垢的主要成分是 CaCO3 和 Mg(OH)2,要加入A进行溶解,所以A为酸,又要的氯化钙,所以是盐酸;
(2)碳酸钙和盐酸反应会生成氯化钙、水和二氧化碳,氢氧化镁和盐酸反应生成氯化镁和水,最后需要制取氯化钙,所以需要将氯化镁沉淀,依据除杂原则可知,B是氢氧化钙,若加入的试剂A、B都是过量的,则加入试剂 B 发生的非中和反应是氯化镁和氢氧化钙反应生成氢氧化镁沉淀和氯化钙,化学方程式为:Ca(OH)2+MgCl2 =Mg(OH)2↓+CaCl2;操作Ⅰ将固体和液体分离,所以为过滤;过滤中用到玻璃仪器外,还需要的实验用品有铁架台(带铁圈)和滤纸;
(3)前面加入的是过量的氢氧化钙,而最后要得到氯化钙,需要将氢氧化钙除去,所以步骤④加酸A的作用是将反应剩余的氢氧化钙除去;
(4)滤液中加入盐酸反应后是盐酸和氯化钙的混合物,所以要从溶液中得到氯化钙,需要用蒸发浓缩、降温结晶、过滤、洗涤、干燥。

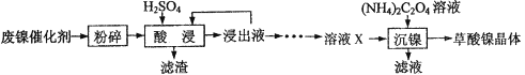
【题目】草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂。某小组用废镍催化剂(成分为Fe2O3、Ni、Fe、SiO2等)制备草酸镍晶体的部分实验流程如下:
已知:①Ni能和稀H2SO4反应。
②相关金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Ni2+ | 6.7 | 9.5 |
③H2O2能将Fe2+氧化为Fe3+
(1)废镍催化剂“粉碎”的目的是______。
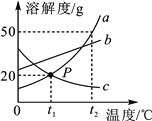
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图,“酸浸”的适宜温度与时间分别为 _______(填字母)。
A.30℃、30min B.90℃、150min C.70℃、120min D.90℃、120min
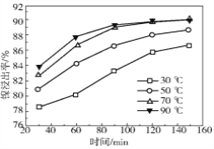
(3)“酸浸”中发生的复分解反应方程式为________。
(4)“浸出液”得到“溶液x”过程中,加入试剂先后顺序是_____(填字母)。
A.先加H2O2溶液,再加NaOH溶液 B.先加NaOH溶液,再加H2O2溶液
加NaOH溶液调节pH_____(填范围),充分反应后得到滤渣的操作是______,该操作中所用到的玻璃仪器有玻璃棒、烧杯和_________。
(5)将“沉镍”工序:①主要过程为:蒸发浓缩、_____ 、过滤,所得固体用75%乙醇洗涤、110℃下烘干,得草酸镍晶体。
②用75%乙醇洗涤的目的是洗去杂质、___________;
③烘干温度不超过110℃的原因是______。