题目内容
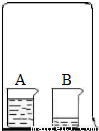 如图所示,在一只倒扣的大烧杯中,正放两只小烧杯.其中A杯中盛有足量浓盐酸,B杯中盛有少量滴有酚酞溶液的NaOH稀溶液.请回答:
如图所示,在一只倒扣的大烧杯中,正放两只小烧杯.其中A杯中盛有足量浓盐酸,B杯中盛有少量滴有酚酞溶液的NaOH稀溶液.请回答:(1)放置一段时间后,B杯中出现的现象是 .
(2)该现象说明.浓盐酸具有的性质是 , ,写出有关反应的化学方程式: .
【答案】分析:首先由指示剂酚酞的性质:碱能使其变红,酸不能使变色然后又题意可知,A杯中足量浓盐酸具有挥发性,可挥发出氯化氢;B杯中盛有少量滴有酚酞溶液的NaOH稀溶液,由于碱能使无色酚酞变红,故该溶液是红色的;当这两个杯子罩在一时,由于A杯浓盐酸挥发出酸性氯化氢慢慢会进入B杯中,然后与B中的氢氧化钠反应,致使碱性逐渐减弱甚至变为中性,溶液的红色也褪去,或者变浅.
解答:解:(1)由于A杯中盛足量浓盐酸挥发出的酸性氯化氢气体逐渐进入B杯中,致使B杯碱性慢慢变弱甚至中性,所以原来的红色也逐渐变无色或变浅;
(2)从实验的现象得出:浓盐酸具有将强的挥发性,可以和氢氧化钠反应;生成水和盐.
故答案:(1)溶液由红色变为无色(或颜色变浅
(2)挥发性;与NaOH反应(或有酸性);HCl+NaOH═NaCl+H2O
点评:本题是利用课本中探究微粒的性质的实验,考查了学生分析问题、解决问题的能力;在这里关键要注意酸、碱、指示剂的关系和性质.
解答:解:(1)由于A杯中盛足量浓盐酸挥发出的酸性氯化氢气体逐渐进入B杯中,致使B杯碱性慢慢变弱甚至中性,所以原来的红色也逐渐变无色或变浅;
(2)从实验的现象得出:浓盐酸具有将强的挥发性,可以和氢氧化钠反应;生成水和盐.
故答案:(1)溶液由红色变为无色(或颜色变浅
(2)挥发性;与NaOH反应(或有酸性);HCl+NaOH═NaCl+H2O
点评:本题是利用课本中探究微粒的性质的实验,考查了学生分析问题、解决问题的能力;在这里关键要注意酸、碱、指示剂的关系和性质.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
 (2007?宁夏)如图所示,在一只倒扣的大烧杯中,正放两只小烧杯.其中A杯中盛有足量浓盐酸,B杯中盛有少量滴有酚酞溶液的NaOH稀溶液.请回答:
(2007?宁夏)如图所示,在一只倒扣的大烧杯中,正放两只小烧杯.其中A杯中盛有足量浓盐酸,B杯中盛有少量滴有酚酞溶液的NaOH稀溶液.请回答: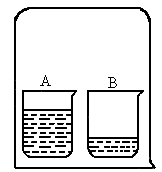
 如图所示,在一只倒扣的大烧杯中,正放两只小烧杯.其中A杯中盛有足量浓盐酸,B杯中盛有少量滴有酚酞溶液的NaOH稀溶液.请回答:
如图所示,在一只倒扣的大烧杯中,正放两只小烧杯.其中A杯中盛有足量浓盐酸,B杯中盛有少量滴有酚酞溶液的NaOH稀溶液.请回答: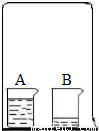 如图所示,在一只倒扣的大烧杯中,正放两只小烧杯.其中A杯中盛有足量浓盐酸,B杯中盛有少量滴有酚酞溶液的NaOH稀溶液.请回答:
如图所示,在一只倒扣的大烧杯中,正放两只小烧杯.其中A杯中盛有足量浓盐酸,B杯中盛有少量滴有酚酞溶液的NaOH稀溶液.请回答: