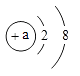题目内容
【题目】实验室部分装置如图所示,请回答下列问题。
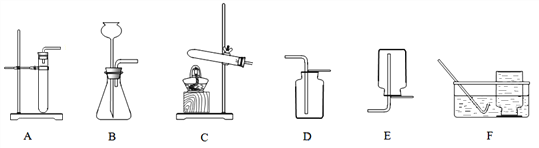
(1)若用KMnO4制取O2,应选用发生装置________(填编号),应选用收集装置_____ 或
_____(填编号),反应的化学方程式是___________。
(2)若用100g含杂质5%的石灰石和盐酸制取CO2(假设杂质不与盐酸反应,石灰石的体积约为34cm3),应选用发生装置_____(填编号),反应的化学方程式是______________,其中CaCO3 与CO2的质量比为_________,反应后最多能生成______gCO2(结果取整数)。
(3)在实验室制取二氧化碳的研究中,进行了如下实验:
实验编号 药品 | 甲 | 乙 | 丙 | 丁 |
m g石灰石 | 块状 | 块状 | 粉末状 | 粉末状 |
w g盐酸 | 稀盐酸 | 浓盐酸 | 稀盐酸 | 浓盐酸 |
①若要研究盐酸的浓、稀对反应的影响,可选择实验甲与______对照(选填实验编号)。
②除盐酸的浓稀外,上述实验研究的另一个影响反应的因素是_____________________。
【答案】 C D F 2KMnO4![]() K2MnO4+MnO2+O2↑ B CaCO3 +2HCl=CaCl2+H2O+CO2↑ 100:44 41.8 乙 石灰石颗粒大小(或反应物的接触面积)
K2MnO4+MnO2+O2↑ B CaCO3 +2HCl=CaCl2+H2O+CO2↑ 100:44 41.8 乙 石灰石颗粒大小(或反应物的接触面积)
【解析】(1)高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,属于固体加热型,应选用发生装置为C,氧气密度比空气大,不易溶于水,故发生装置选D或
E,反应的化学方程式是:2KMnO4![]() K2MnO4+MnO2+O2↑;(2)实验室制取二氧化碳。是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,可选用B装置,反应的化学方程式为CaCO3+2HCl= CaCl2+H2O+CO2↑;其中 CaCO3与CO2的质量比为100 :44,生成二氧化碳的质量为
K2MnO4+MnO2+O2↑;(2)实验室制取二氧化碳。是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,可选用B装置,反应的化学方程式为CaCO3+2HCl= CaCl2+H2O+CO2↑;其中 CaCO3与CO2的质量比为100 :44,生成二氧化碳的质量为![]() ,
,
CaCO3 +2 HCI= CaCl2 +H2O +CO2↑
100 44
100× (1-5%) ![]()
![]() ,
, ![]() =41.80,(3)①对比实验数据可见,甲和乙均为m g块状大理石,wg盐酸,但是盐酸的浓度不同,可选择实验甲与乙对照;②甲和丙对比,乙和丁对比可知,实验研究的另一个影响反应的因素是固体反应物的颗粒大小(或反应物的接触面积))。
=41.80,(3)①对比实验数据可见,甲和乙均为m g块状大理石,wg盐酸,但是盐酸的浓度不同,可选择实验甲与乙对照;②甲和丙对比,乙和丁对比可知,实验研究的另一个影响反应的因素是固体反应物的颗粒大小(或反应物的接触面积))。

 阅读快车系列答案
阅读快车系列答案