题目内容
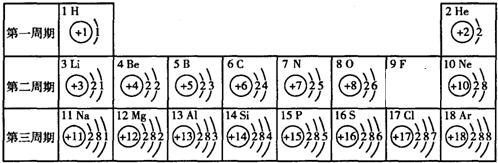
俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.下表为元素周期表的部分元素的相关信息,利用下表回答有关问题:
(1)请在图中相应位置写出16号元素的符号并画出16号元素原子结构示意图
 ,化学反应中该原子比较容易
,化学反应中该原子比较容易
(2)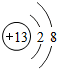 表示的是
表示的是
(3)写出上表中8号元素的单质与15号元素的单质之间反应的化学方程式
(4)上表中第二、三周期元素最外层电子数的变化规律是
| 第一周期 | 1H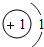 |
2He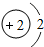 | ||||||
| 第二周期 | 3Li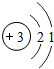 |
4Be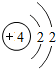 |
5B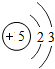 |
6C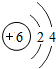 |
7N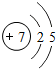 |
8O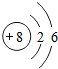 |
9F |
10Ne |
| 第三周期 | 11Na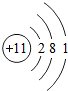 |
12Mg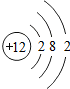 |
14Si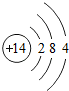 |
15P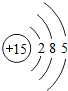 |
17Cl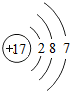 |
18Ar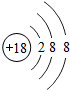 | ||


得到
得到
(填“得到”或“失去”)电子变成离子;(2)
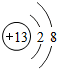 表示的是
表示的是Al3+
Al3+
(填离子符号);(3)写出上表中8号元素的单质与15号元素的单质之间反应的化学方程式
4P+5O2
2P2O5
| ||
4P+5O2
2P2O5
;
| ||
(4)上表中第二、三周期元素最外层电子数的变化规律是
从左到右最外层电子数由1递增到8
从左到右最外层电子数由1递增到8
.分析:(1)根据原子结构示意图的各部分的意义分析解答;
(2)根据粒子结构示意图分析.
(3)根据元素原子中的原子序数=质子数进行判断8号元素和15号元素,然后元素组成化合物的化学式的书写来完成解答即可;
(4)根据表中各元素最外层电子数的特点分析规律.
(2)根据粒子结构示意图分析.
(3)根据元素原子中的原子序数=质子数进行判断8号元素和15号元素,然后元素组成化合物的化学式的书写来完成解答即可;
(4)根据表中各元素最外层电子数的特点分析规律.
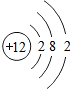
解答:解:(1)根据原子结构示意图的画法画出硫原子的结构示意图为 ,最外层有6个电子,易得到两个成为8电子的相对稳定结构.
,最外层有6个电子,易得到两个成为8电子的相对稳定结构.
(2)此粒子结构图中质子数为13,是硫元素,核外有10个电子,是阳离子,故符号为Al3+;
(3)根据元素原子中的原子序数=质子数进行判断8号元素为氧元素,15号元素为磷元素,其中氧元素可以组成氧气,而磷元素组成单质磷,它们反应的化学方程式为:4P+5O2
2P2O5;
(4)观察表中第二三周期各元素最外层电子数的变化可以看出从左到右最外层电子数由1递增到8.
故答案为:(1) ;得到;
;得到;
(2)Al3+;
(3)4P+5O2
2P2O5;
(4)从左到右最外层电子数由1递增到8.
 ,最外层有6个电子,易得到两个成为8电子的相对稳定结构.
,最外层有6个电子,易得到两个成为8电子的相对稳定结构.(2)此粒子结构图中质子数为13,是硫元素,核外有10个电子,是阳离子,故符号为Al3+;
(3)根据元素原子中的原子序数=质子数进行判断8号元素为氧元素,15号元素为磷元素,其中氧元素可以组成氧气,而磷元素组成单质磷,它们反应的化学方程式为:4P+5O2
| ||
(4)观察表中第二三周期各元素最外层电子数的变化可以看出从左到右最外层电子数由1递增到8.
故答案为:(1)
 ;得到;
;得到; (2)Al3+;
(3)4P+5O2
| ||
(4)从左到右最外层电子数由1递增到8.
点评:本题考查学生根据原子结构示意图分析总结元素周期律及对元素的性质与最外层电子数的关系的理解与掌握,并能在解题中灵活应用.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
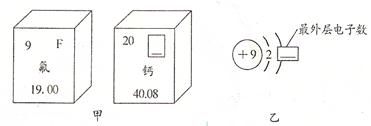

 表示的是
表示的是








 10Ne
10Ne



 18Ar
18Ar 表示的是
表示的是

 表示的是
表示的是