题目内容
(2009?淮安)现有一瓶未开启的浓硫酸,标签如图所示.试求:| 硫酸 化学纯 (500mL) 化学式 H2SO2 密度 1.84g/cm3 质量分数 98% |
(2)取上述配制好的稀硫酸50g与足量的锌粒反应,生成氢气的质量是多少克(列式计算)?
【答案】分析:(1)根据稀释前后溶液中溶质的质量量相等求出浓硫酸的质量,再用 求出浓硫酸的体积.
求出浓硫酸的体积.
(2)利用锌和硫酸反应的化学方程式,根据稀硫酸中硫酸的质量求出氢气的质量.
解答:解:(1)浓硫酸的质量=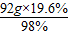 =18.4g 浓硫酸的体积=
=18.4g 浓硫酸的体积=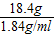 =10ml
=10ml
(2)50g×19.6%=9.8g
设氢气的质量为x
Zn+H2SO4=ZnSO4+H2↑
98 2
9.8g x
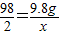 ,x=0.2g
,x=0.2g
答:生成氢气的质量是0.2g.
点评:稀释浓硫酸时,浓硫酸的质量+水的质量=稀硫酸的质量,而浓硫酸的体积+水的体积>稀硫酸的体积,因为分子之间有间隔.
 求出浓硫酸的体积.
求出浓硫酸的体积.(2)利用锌和硫酸反应的化学方程式,根据稀硫酸中硫酸的质量求出氢气的质量.
解答:解:(1)浓硫酸的质量=
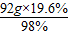 =18.4g 浓硫酸的体积=
=18.4g 浓硫酸的体积=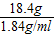 =10ml
=10ml(2)50g×19.6%=9.8g
设氢气的质量为x
Zn+H2SO4=ZnSO4+H2↑
98 2
9.8g x
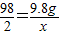 ,x=0.2g
,x=0.2g答:生成氢气的质量是0.2g.
点评:稀释浓硫酸时,浓硫酸的质量+水的质量=稀硫酸的质量,而浓硫酸的体积+水的体积>稀硫酸的体积,因为分子之间有间隔.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目