题目内容
手机中使用的锂(Li)电池是新型的高能电池,锂是自然界密度最小的金属元素,银白色,很柔软,可溶于液氨.锂是一种活动性比铁强的金属.它是原子结构示意图为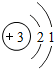 ,
,
(1)写出锂离子的符号 锂的氧化物的化学式
(2)金属锂的物理性质有 , .(写出两点即可)
(3)写出锂与稀硫酸反应的化学方程式 .
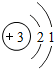 ,
,(1)写出锂离子的符号
(2)金属锂的物理性质有
(3)写出锂与稀硫酸反应的化学方程式
考点:金属的化学性质,化学符号及其周围数字的意义,化学性质与物理性质的差别及应用,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:离子所带电荷数与原子得失电子的数目有关,氧化物是指由两种元素组成,其中一种元素为氧元素的化合物,物质的物理性质主要从颜色、状态、密度、硬度等方面考虑,锂是一种活动性比铁强的金属,故可以与酸发生置换反应生成氢气.
解答:解:
(1)由锂原子结构示意图可以发现,其最外层电子数为1,易失去一个电子,形成带一个单位正电荷的阳离子Li+;锂离子带一个单位的正电荷,故其化合价为+1价,氧元素的化合价为-2价,根据化合价原则,其化学式为:Li2O;所以本题答案为:Li+;Li2O;
(2)根据题干提供的信息,锂的密度小,为银白色很柔软的金属,可溶于液氨,所以本题答案为:密度小、可溶于液氨等;
(3)锂是一种活动性比铁强的金属可以与稀硫酸发生置换反应生成硫酸锂和氢气,所以本题答案为:2Li+H2SO4═Li2SO4+H2↑.
故答案为:
(1)Li+;Li2O;
(2)密度小、可溶于液氨等;
(3)2Li+H2SO4═Li2SO4+H2↑.
(1)由锂原子结构示意图可以发现,其最外层电子数为1,易失去一个电子,形成带一个单位正电荷的阳离子Li+;锂离子带一个单位的正电荷,故其化合价为+1价,氧元素的化合价为-2价,根据化合价原则,其化学式为:Li2O;所以本题答案为:Li+;Li2O;
(2)根据题干提供的信息,锂的密度小,为银白色很柔软的金属,可溶于液氨,所以本题答案为:密度小、可溶于液氨等;
(3)锂是一种活动性比铁强的金属可以与稀硫酸发生置换反应生成硫酸锂和氢气,所以本题答案为:2Li+H2SO4═Li2SO4+H2↑.
故答案为:
(1)Li+;Li2O;
(2)密度小、可溶于液氨等;
(3)2Li+H2SO4═Li2SO4+H2↑.
点评:本题考查了金属锂的有关物理性质和化学性质,完成此题,可以根据题干提供的内容,从中抽取有用的信息来进行.

练习册系列答案
相关题目
下列物质中化学性质最稳定的是( )
| A、O2 |
| B、Na |
| C、Ne |
| D、H2O |
无铅汽油一般是加入甲基叔丁基醚CH3OC(CH3)3作为高辛烷值组成.下列关于它的叙述错误的是( )
| A、甲基叔丁基醚属于纯净物 |
| B、甲基叔丁基醚的相对分子质量为88 |
| C、甲基叔丁基醚中碳元素的质量分数约为68.2% |
| D、甲基叔丁基醚是由5个碳原子、12个氢原子和1个氧原子构成的 |
 根据下列粒子的结构示意图,按要求填空:
根据下列粒子的结构示意图,按要求填空: