题目内容
甲醇(CH3OH)是一种有毒、有酒精气味可燃性液体.甲醇在氧气中完全燃烧反应表示为:2CH3OH+nO2=mCO2+pH2O(其中n、m、p表示化学计量数),若反应生成3.6g水.试计算:(1)m值是______;
(2)参加反应的氧气的质量是多少克?(请写出规范的计算步骤)
【答案】分析:(1)根据质量守恒定律,在化学反应前后原子的种类和数目都没有改变.由已知反应物中C原子总数为2,生成物中C原子总数也应该为2,则可以求得m=2,反应物中氢原子的个数为8,所以p的值为4,再由生成物氧原子总数和甲醇中氧原子总数可以求出n=3.
(2)由方程式中可以找出参加反应的氧气和生成水的质量比,再由生成水的质量可以求得参加反应的氧气质量.
解答:解:(1)根据质量守恒定律,在化学反应前后原子的种类和数目都没有改变.由已知反应物中C原子总数为2,生成物中C原子总数也应该为2,则可以求得m=2,反应物中氢原子的个数为8,所以p的值为4,再由生成物氧原子总数和甲醇中氧原子总数可以求出n=3.
(2)设参加反应的氧气质量为X
2CH3OH+3O2 2CO2+4H2O
2CO2+4H2O
96 72
x 3.6g
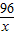 =
=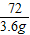
解得:x=4.8g
答:参加反应的氧气的质量是4.8g.
故答案为:(1)3;
(2)4.8g.
点评:解此类题要依据质量守恒定律,化学反应前后元素种类及原子个数不变,分别统计出反应前后有关原子种类及个数,比较分析可以得出m、n、p的值;从而可以写出完整的化学方程式,再根据方程式中各物质之间的质量关系,就可以求出某种未知的物质的质量.
(2)由方程式中可以找出参加反应的氧气和生成水的质量比,再由生成水的质量可以求得参加反应的氧气质量.
解答:解:(1)根据质量守恒定律,在化学反应前后原子的种类和数目都没有改变.由已知反应物中C原子总数为2,生成物中C原子总数也应该为2,则可以求得m=2,反应物中氢原子的个数为8,所以p的值为4,再由生成物氧原子总数和甲醇中氧原子总数可以求出n=3.
(2)设参加反应的氧气质量为X
2CH3OH+3O2
 2CO2+4H2O
2CO2+4H2O96 72
x 3.6g
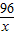 =
=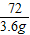
解得:x=4.8g
答:参加反应的氧气的质量是4.8g.
故答案为:(1)3;
(2)4.8g.
点评:解此类题要依据质量守恒定律,化学反应前后元素种类及原子个数不变,分别统计出反应前后有关原子种类及个数,比较分析可以得出m、n、p的值;从而可以写出完整的化学方程式,再根据方程式中各物质之间的质量关系,就可以求出某种未知的物质的质量.

练习册系列答案
相关题目
(1)甲醇(CH3OH)是一种有毒、有酒的气味的可燃性液体.甲醇在氧气中不完全燃烧可发生如下反应:8CH3OH+nO2
mCO2+2CO+16H2O.请回答:甲醇的摩尔质量为 ,反应中m值是 .
(2)为了测定一定体积某盐酸所含溶质氯化氢的物质的量,现取100毫升该盐酸,加入足量的铁粉,依次测量t1~t5时产生氢气的质量,记录的数据见下表:
①上述化学反应的基本类型为 .根据上表分析,反应时间为 s时不再有气泡产生.
②列式计算100毫升盐酸中含氯化氢多少摩尔?
| ||
(2)为了测定一定体积某盐酸所含溶质氯化氢的物质的量,现取100毫升该盐酸,加入足量的铁粉,依次测量t1~t5时产生氢气的质量,记录的数据见下表:
| 反应时间/s | t1 | t2 | t3 | t4 | t5 |
| 生成H2的质量/g | 0.03 | 0.06 | 0.08 | 0.10 | 0.10 |
②列式计算100毫升盐酸中含氯化氢多少摩尔?