题目内容
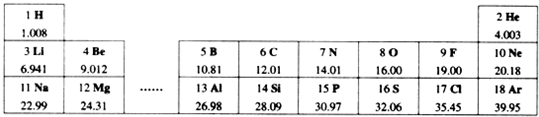
元素周期表是化学学习的重要工具,依据下表回答问题:
(1)表中14号元素属于
(2)通过上表的分析可知:元素所在的周期数=
(3)根据上表中原子核外电子排布规律,原子序数为19的钾元素的原子结构示意图为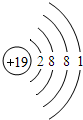
 ,钾元素的原子在化学反应中容易形成离子,该离子符号是
,钾元素的原子在化学反应中容易形成离子,该离子符号是
| 第一周期 | 1H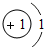 |
2He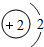 | ||||||
| 第二周期 | 3Li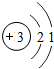 |
4Be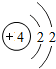 |
5B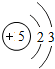 |
6C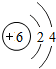 |
7N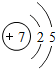 |
8O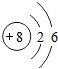 |
9F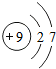 |
10Ne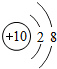 |
| 第三周期 | 11Na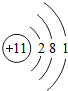 |
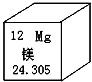
12Mg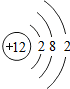 |
13Al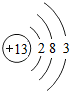 |
14Si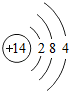 |
15P |
16S |
17Cl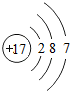 |
18Ar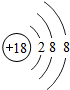 |
非金属
非金属
(填“金属”或“非金属”)元素,该元素的化学性质与碳
碳
元素相似,即在常温下具有稳定
稳定
性.(2)通过上表的分析可知:元素所在的周期数=
该元素原子核外的电子层数
该元素原子核外的电子层数
,元素所在的族数=该元素原子的最外层电子数.(3)根据上表中原子核外电子排布规律,原子序数为19的钾元素的原子结构示意图为


K+
K+
.分析:(1)根据汉字偏旁可判断元素类别,最外层电子数决定元素化学性质;
(2)根据元素周期表进行分析;
(3)根据元素周期表和离子符号的写法进行分析.
(2)根据元素周期表进行分析;
(3)根据元素周期表和离子符号的写法进行分析.
解答:解:(1)14号元素是硅,硅元素带石字旁,是非金属元素;最外层电子数决定元素的化学性质,最外层电子数相同的元素,化学性质相似,硅元素原子最外层电子数为4,碳元素原子最外层电子数为4,因此硅、碳元素的化学性质相似,常温下也具有稳定性;
故答案为:非金属;碳;稳定;
(2)通过上表的分析可知:元素所在的周期数=元素原子的电子层数,元素所在的族数=该元素原子的最外层电子数;
故答案为:该元素原子核外的电子层数;
(3)根据上表中原子核外电子排布规律,原子序数为19的钾元素在第四周期、第一主族,应有4个电子层,最外层电子数是1,因此钾原子结构示意图为 ;钾元素的原子最外层有一个电子,在化学反应中容易失去1个电子形成氧离子,该离子符号是K+.
;钾元素的原子最外层有一个电子,在化学反应中容易失去1个电子形成氧离子,该离子符号是K+.
故答案为: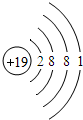 ;K+.
;K+.
故答案为:非金属;碳;稳定;
(2)通过上表的分析可知:元素所在的周期数=元素原子的电子层数,元素所在的族数=该元素原子的最外层电子数;
故答案为:该元素原子核外的电子层数;
(3)根据上表中原子核外电子排布规律,原子序数为19的钾元素在第四周期、第一主族,应有4个电子层,最外层电子数是1,因此钾原子结构示意图为
 ;钾元素的原子最外层有一个电子,在化学反应中容易失去1个电子形成氧离子,该离子符号是K+.
;钾元素的原子最外层有一个电子,在化学反应中容易失去1个电子形成氧离子,该离子符号是K+.故答案为:
 ;K+.
;K+.点评:本题主要考查元素周期表的结构、元素周期律等知识,要求学生掌握原子结构示意图的画法以及原子得失电子的判断方法.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目