题目内容
【题目】某含有镁粉的固体样品A中,可能混进了MgO、CuSO4、Na2CO3三种物质中的一种或多种.为确定样品成分,按如图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全进行).
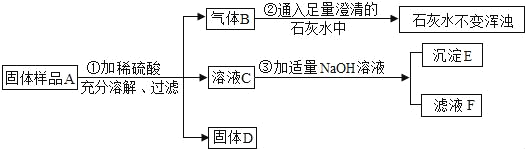
试根据实验过程和发生的现象判断:
(1)产生的气体B是(写化学式)_____,由实验②可以判断固体中一定没有_____(写化学式).
(2)固体D的颜色是_____色.
(3)写出产生沉淀E的化学方程式_____.
(4)滤液F中一定含有的阴离子是_____.
(5)仅根据上述现象,还不能确定混入镁粉的物质是(写化学式)_____,做出此判断的原因是_____.
【答案】H2 Na2CO3 紫红 MgSO4+2NaOH=Na2SO4+Mg(OH)2↓ SO42- MgO 镁、氧化镁都会与硫酸反应生成硫酸镁
【解析】
气体B不能使澄清石灰水变浑浊,所以B不是二氧化碳,混合物中不含碳酸钠,镁和稀硫酸反应生成氢气,所以B是氢气,镁和硫酸铜反应会生成硫酸镁和铜,所以D是铜,氧化镁和硫酸会生成硫酸镁和水,镁和硫酸反应会生成硫酸镁和氢气,溶液C和氢氧化钠会生成沉淀E,所以C是硫酸镁,E是氢氧化镁,F是硫酸钠。
(1)产生的气体B是![]() ,由实验②可以判断固体中一定没有
,由实验②可以判断固体中一定没有![]() 。
。
(2)固体D是铜,颜色是紫红色;
(3)产生沉淀E的反应是氢氧化钠和硫酸镁反应生成氢氧化镁沉淀和硫酸钠,化学方程式为![]() 。
。
(4)滤液F中一定含有的阴离子是![]()
(5)仅根据上述现象,还不能确定混入镁粉的物质是MgO,做出此判断的原因是:镁、氧化镁都会与硫酸反应生成硫酸镁.

练习册系列答案
相关题目