题目内容
向一密闭容器中加入甲、乙、丙、丁4种物质,在一定条件下发生化学反应,测得有关数据如图,下列说法不正确的是
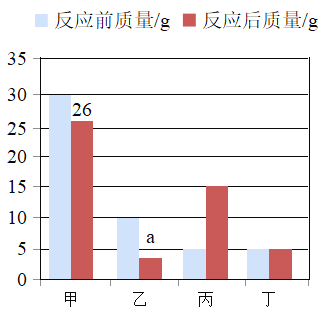
A.a的数值是4
B.丙一定属于化合物
C.参加反应的甲和丙的质量比为3∶5
D.丁可能不参加反应
 阅读快车系列答案
阅读快车系列答案某化学兴趣小组针对教科书中两个实验进行再探究。
(探究一)空气中氧气含量测定的再认识
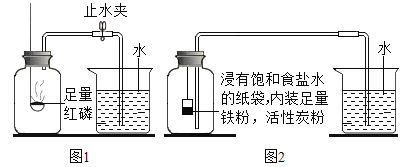
(1)测定装置如图1所示,红磷燃烧消耗氧气,使集气瓶内_____减小,烧杯中的水倒吸进入集气瓶。但该实验误差较大,测得空气中氧气含量明显低于 。
。
(实验改进)根据铁在空气中生锈的原理设计实验如图2所示,装置中饱和食盐水、活性炭能加快铁生锈的速率,测得数据如下表:
实验前 | 实验后 | |
烧杯中水的体积/mL | 烧杯中剩余水的体积/mL | 集气瓶(扣除内容物)和导管的容积/mL |
80.8 | 54.5 | 126.0 |
(2)根据上表信息,空气中氧气的体积分数为_____(只列式,不计算)。
(3)从实验原理角度分析,改进后的实验结果更准确的原因是_____(写一点)。
(探究二)铁在氧气中燃烧后所得固体物质成分的探究
(问题1)铁燃烧时溅落下来的黑色物质中是否含有铁?
(资料)① 自然界中铁的氧化物主要是Fe3O4(黑色)和Fe2O3(红棕色)两种;
② FeO(黑色)极易被氧化为Fe2O3;
③ 铁的氧化物均能与稀盐酸或稀硫酸反应生成铁的化合物溶液。
(实验)将冷却后的黑色物质碾碎,装入试管,加入_____溶液,观察到_____的现象,说明铁燃烧时溅落下来的黑色物质中含有铁。
(问题2)铁燃烧的产物为什么不是Fe2O3?
(资料)① Fe3O4和Fe2O3的分解温度、铁的熔点见表;
Fe3O4 | Fe2O3 | 铁 | |
分解温度/℃ | 1538 | 1400 | — |
熔点/℃ | — | — | 1535 |
② Fe2O3高温时分解成Fe3O4。
(证据推理)根据实验现象及表中信息可知,铁在氧气里燃烧时产生的高温应在_____之间,此时Fe2O3已分解。
(拓展延伸)(1)为了防止集气瓶炸裂,必须采取_____的措施。
(2)某食品密封包装盒的透明盖内放有黑色的FeO粉末,若颜色_____,说明包装盒漏气。
(3)Fe2O3高温时会分解成Fe3O4和一种气体,该反应的化学方程式为_____。
把一定质量的甲、乙、丙、丁四种物质放在密闭容器中,在一定条件下反应一段时间后,测得反应前后各物质的质量如下表所示,下列说法正确的是( )
物质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量/g | 5 | 9 | 16 | 3 |
反应后的质量/g | x | 20 | 1 | 7 |
A.反应中的乙和丁的质量比为3:1
B.物质丙可能是单质
C.该反应为化合反应
D.x=5



 点燃酒精灯 B.
点燃酒精灯 B.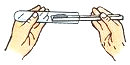 取用碳酸钠
取用碳酸钠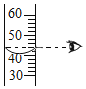 读取量筒中液体体积 D.
读取量筒中液体体积 D. 加入石灰石
加入石灰石