题目内容
【题目】以MnO2为原料制备MnSO4H2O的工业流程如图。
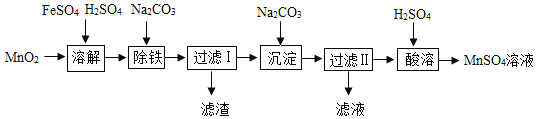
已知:①沉淀时的化学方程式为7MnSO4+7Na2CO3+11H2O=MnCO36Mn(OH)25H2O↓+7Na2SO4+6CO2↑
②MnSO4H2O和MnSO45H2O易溶于水,难溶于乙醇。
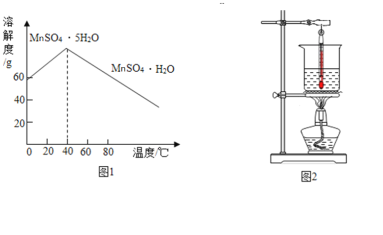
③MnSO4的溶解度曲线如图1所示。
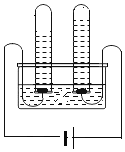
(1)溶解时,为控制80℃,在实验室可用水浴加热如图2.水浴加热需要的玻璃仪器有酒精灯、_____、_____。水浴加热的优点有_____。能加快溶解的方法有_____(写一种)。
(2)除铁时需要搅拌,搅拌的作用是_____。
(3)过滤I所得滤液的溶质主要是Na2SO4和_____。过滤时,玻璃棒的作用是_____。
(4)酸溶时,MnCO36Mn(OH)25H2O与足量稀硫酸反应的化学方程式为_____。
(5)请补充完整由流程中“酸溶”所得MnSO4溶液制备MnSO4H2O的实验方案:将MnSO4溶液转移至蒸发皿中,_____,在高于40℃时趁热过滤,_____,100℃烘干得MnSO4H2O。
【答案】烧杯 温度计 温度控制准确 提高温度、搅拌(只需写一种) 加快反应 MnSO4 引流 MnCO36Mn(OH)25H2O +7H2SO4═7MnSO4+18H2O+CO2↑ 加热浓缩 乙醇洗涤
【解析】
(1)溶解时,为控制80℃,根据水浴加热图可知,水浴加热需要的玻璃仪器有酒精灯、烧杯、温度计。水浴加热的优点有:温度控制准确。能加快溶解的方法有:提高温度、搅拌等(只需写一种)。
(2)除铁时需要搅拌,由于反应物之间接触越充分,反应越快,所以搅拌的作用是:加快反应。
(3)由于过滤I所得滤液后续用于制备硫酸锰,所以对应的溶质除了Na2SO4还一定含有:MnSO4。过滤时,玻璃棒的作用是:引流。
(4)酸溶时,MnCO36Mn(OH)25H2O与足量稀硫酸反应生成硫酸锰和水以及二氧化碳,对应的化学方程式为 MnCO36Mn(OH)25H2O+7H2SO4═7MnSO4+18H2O+CO2↑。
(5)因为在第一步溶解后的流程中,操作在常温下进行,同时由流程中“酸溶”所得MnSO4溶液浓度不是很高,所以由流程中“酸溶”所得MnSO4溶液制备MnSO4H2O的实验方案:将MnSO4溶液转移至蒸发皿中,为了提高浓度必须先加热浓缩;因为高于40℃时析出的晶体才是MnSO4H2O,所以必须在高于40℃时趁热过滤;因为MnSO4H2O易溶于水,难溶于乙醇,用乙醇洗涤一方面减少因为水溶解造成的损失,另外一方面乙醇易挥发,以便后期干燥,所以趁热过滤后,进行乙醇洗涤;最后在100℃烘干得MnSO4H2O。