题目内容
【题目】写出下列反应的化学方程式(要配平:)
(1)高锰酸钾受热分解__________________________________;
(2)铁在氧气中燃烧 _____________________________________________;
(3)实验室制取二氧化碳 ___________________________________________;
(4)二氧化碳通入澄清石灰水 _________________________________________。
【答案】 2KMnO4![]() K2MnO4+MnO2+O2↑ 2O2+ 3Fe
K2MnO4+MnO2+O2↑ 2O2+ 3Fe ![]() Fe3O4 2HCl + Ca CO3 = CaCl2 + 2H2O+ CO2↑ CO2+ Ca(OH)2 = Ca CO3 ↓+ H2O
Fe3O4 2HCl + Ca CO3 = CaCl2 + 2H2O+ CO2↑ CO2+ Ca(OH)2 = Ca CO3 ↓+ H2O
【解析】(1)高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(2)铁在氧气中燃烧生成四氧化三铁,反应的化学方程式为:2O2+ 3Fe ![]() Fe3O4;
Fe3O4;
(3)实验室制取二氧化碳时,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:2HCl+CaCO3=CaCl2+2H2O+CO2↑;
(4)二氧化碳通入澄清石灰水中时,氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O。

【题目】草酸钙(化学式为CaC2O4,相对分子质量为128)是一种难溶于水的白色固体,受热能分解。小红同学为了探究其在加热条件下发生的变化,进行如下实验:取12.8g草酸钙固体在不断加热的条件下测得剩余固体的质量随时间变化如右图所示。请回答下列问题:
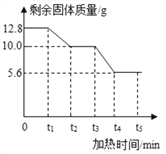
(1)t1~t2时问段内固体质量减少的原因是产生了一种极易与血红蛋白结合的有毒气体,该气体的化学式为_________;同时生成一种白色固体,它与大理石的主要成分相同,则该段时问内反应的化学方程式_______________________ 。
(2)t2~t3时间段内固体质量不变的原因是______________________ 。
(3)t3~t4时间段内反应的化学方程式为____________________________。
(4)小强和小明两位同学另取12.8g草酸钙固体加热一段时间后,对剩余固体的成分进行探究。
【查阅资料】氢氧化钙微溶于水,能与盐酸反应:Ca(OH)2+2HCl=CaCl2+H2O;CaC2O4能与稀盐酸反应,其反应的化学方程式为:CaC2O4+2HCl=CaCl2+H2C2O4;草酸(H2C2O4)是一种可溶于水的酸;
【设计方案并实验】
同学 | 实验操作 | 实验现象 | 结论 |
小强 | 取少量固体放入烧杯中,加足量水搅拌 | 烧杯发热 | 剩余固体中一定含有_________。一定不含有CaC2O4。 |
小明 | 另取少量固体放入试管中,加足量稀盐酸 | 有气体产生 | 剩余固体中一定含有__________。 |
【交流与讨论】三位同学经过交流后认为,该剩余固体与图中___________时间段的物质成分相同。
(5)某同学取用上述制得的生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂,如图:

①塑料试剂瓶膨胀破裂的原因是(用反应的化学方程式表示)____________ 。
②破裂后瓶内试剂会吸收空气中CO2生成CaCO3。
为测定其中CaCO3的质量分数,兴取小组进行如下实验:
实验1:称取10.0g样品,加50.0g水溶解,搅拌、静置、过滤,将沉淀洗涤、干燥、称重。
实验2:称取10.0g样品,向其中加入足量稀盐酸,充分反应,收集产生的气体。
a.根据实验1称重计算样品中CaCO3的质量分数可能偏高,原因____________________。
b.若实验2中收集的气体为2.2g,计算样品中CaCO3的质量分数为了___________。(请写出计算过程)