题目内容
【题目】现有家庭食用碱样品12g(主要成分Na2CO3 , 其它成分不与酸反应),向其中加入某未知浓度的盐酸,生成气体的质量与加入盐酸的质量关系如图.请计算: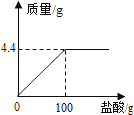
①食用碱中碳酸钠的纯度是多少?
②盐酸的溶质的质量分数是多少?(要求写出计算过程,结果精确到0.1)
【答案】解:①设12g纯碱样品中含Na2CO3的质量为x,100g盐酸中含氯化氢的质量为y,
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 44
x y 4.4g![]() ,
,
x=10.6g
y=7.3g;
纯碱样品中的Na2CO3的质量分数是:![]() ×100%=88.3%;
×100%=88.3%;
②盐酸的溶质的质量分数是:![]() ×100%=7.3%;
×100%=7.3%;
答:①纯碱样品中的Na2CO3的质量分数是88.3%;②盐酸的溶质的质量分数是7.3%.
【解析】①根据生成气体的质量算出碳酸钠的质量,再用碳酸钠的质量除以样品的质量解答即可;
②根据生成气体的质量计算出参加反应的氯化氢的质量,再用氯化氢的质量除以参加反应的盐酸溶液质量即可解答
【考点精析】利用根据化学反应方程式的计算对题目进行判断即可得到答案,需要熟知各物质间质量比=系数×相对分子质量之比.

练习册系列答案
相关题目