题目内容
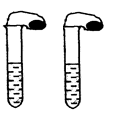
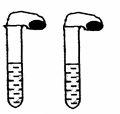
高中教材中有这样一个实验:在两支同样大小的试管中分别加入3mL(足量)稀盐酸,将两个各装有0.3g NaHCO3或Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3或Na2CO3粉末同时倒入试管中,观察到现象如下:

(1)试管中(填产生沉淀或气体及反应速率等相关现象)
;
(2)盛NaHCO3的试管中气球变得更大,大小气球体积之比约为(填最简整数比)_______;
(3)等质量的两种固体完全反应后生成气体质量不等,但等质量的稀盐酸完全反应后生成气体质量相等,这个结论正确吗?________________。
(1)碳酸氢钠反应速率快,且盛NaHCO3的试管中气球变得更大;(2)53:42
(3)不正确,应该是两种固体足量时,质量的稀盐酸完全反应后生成气体质量相等。
解析:(1)碳酸氢钠反应速率快,且盛NaHCO3的试管中气球变得更大;(2)等质量的两种固体与足量酸反应时产生的气体质量与其相对分子质量成反比所以为53:42
(3)不正确,应该是两种固体足量时,质量的稀盐酸完全反应后生成气体质量相等。
【答案】(1)碳酸氢钠反应速率快,且盛NaHCO3的试管中气球变得更大;(2)53:42
(3)不正确,应该是两种固体足量时,质量的稀盐酸完全反应后生成气体质量相等。
解析:(1)碳酸氢钠反应速率快,且盛NaHCO3的试管中气球变得更大;(2)等质量的两种固体与足量酸反应时产生的气体质量与其相对分子质量成反比所以为53:42
(3)不正确,应该是两种固体足量时,质量的稀盐酸完全反应后生成气体质量相等。

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
(1)高中教材中有这样一个实验:在两支试管中分别加入3mL(足量)稀盐酸,将两个各装有0.3g NaHCO3或Na2CO3粉末的小气球分别套在两支试管口.(已知:Na2CO3与稀盐酸时先发生:Na2CO3+HCl=NaCl+NaHCO3,然后NaHCO3发生:NaHCO3+HCl=NaCl+H2O+CO2↑)当将气球内的NaHCO3或Na2CO3粉末同时倒入试管中,观察到现象如下:
①试管中(填产生沉淀或气体及反应速率等相关现象) .
②盛 的试管中气球变得更大,大小气球(包含试管)体积之比约为(填最简整数比) ;
③等质量的两种固体完全反应后生成气体质量不等,但等质量的稀盐酸完全反应后生成气体质量相等,这个结论正确吗?
④综上所述,在泡沫灭火器中常选用 来产生CO2(选填NaHCO3或Na2CO3)
(2)为研究是吸热还是放热反应,继续进行了下列实验(每个实验各做3次,取平均值):
请你帮助填写相关内容:
①该研究报告的题目是《 》
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为 和 ;通过上述实验可得出四条结论:
a:NaHCO3 的溶解是 (吸热或放热)过程;
b:Na2CO3 溶解是 (吸热或放热)过程;
c:NaHCO3的饱和溶液和盐酸的反应是 (吸热或放热)反应;
d:Na2CO3的饱和溶液和盐酸的反应是 (吸热或放热)反应.
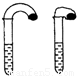
①试管中(填产生沉淀或气体及反应速率等相关现象) .
②盛 的试管中气球变得更大,大小气球(包含试管)体积之比约为(填最简整数比) ;
③等质量的两种固体完全反应后生成气体质量不等,但等质量的稀盐酸完全反应后生成气体质量相等,这个结论正确吗?
④综上所述,在泡沫灭火器中常选用 来产生CO2(选填NaHCO3或Na2CO3)
(2)为研究是吸热还是放热反应,继续进行了下列实验(每个实验各做3次,取平均值):
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| ① | 35mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 2.5g Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10mL水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5g NaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 2.5g Na2CO3固体 | 20℃ | 25.1℃ |
①该研究报告的题目是《 》
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为 和 ;通过上述实验可得出四条结论:
a:NaHCO3 的溶解是 (吸热或放热)过程;
b:Na2CO3 溶解是 (吸热或放热)过程;
c:NaHCO3的饱和溶液和盐酸的反应是 (吸热或放热)反应;
d:Na2CO3的饱和溶液和盐酸的反应是 (吸热或放热)反应.

 (1)高中教材中有这样一个实验:在两支试管中分别加入3mL(足量)稀盐酸,将两个各装有0.3g NaHCO3或Na2CO3粉末的小气球分别套在两支试管口.(已知:Na2CO3与稀盐酸时先发生:Na2CO3+HCl=NaCl+NaHCO3,然后NaHCO3发生:NaHCO3+HCl=NaCl+H2O+CO2↑)当将气球内的NaHCO3或Na2CO3粉末同时倒入试管中,观察到现象如下:
(1)高中教材中有这样一个实验:在两支试管中分别加入3mL(足量)稀盐酸,将两个各装有0.3g NaHCO3或Na2CO3粉末的小气球分别套在两支试管口.(已知:Na2CO3与稀盐酸时先发生:Na2CO3+HCl=NaCl+NaHCO3,然后NaHCO3发生:NaHCO3+HCl=NaCl+H2O+CO2↑)当将气球内的NaHCO3或Na2CO3粉末同时倒入试管中,观察到现象如下: