题目内容
(2003?济南)在托盘天平的两边各放一只烧杯,调节天平至平衡,向两烧杯中分别注入等质量、等质量分数稀盐酸,然后向右盘的烧杯中放入一定质量的铁,同时向左盘的烧杯中放入与铁等质量的铝,待充分反应后,不可能出现的现象是( )
【答案】分析:根据物质之间的反应以及反应的化学方程式进行分析,从酸过量和金属过量两个方面分析.
解答:解:若酸过量,则金属全部参加反应,设金属的质量为54,由铁生成的氢气的质量为x,
2Al+6HCl═2AlCl3+3H2↑
54 6
Fe+2HCl═FeCl2+H2↑
56 2
54 x
 =
=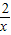
x=1.9
可以看出相同质量的铝和铁与足量的盐酸反应,铝生成的氢气质量比铁多,故天平会指向加铁的一方,
若酸量不足,则酸全部参加反应,相同的酸生成氢气的质量相等,故天平会仍然平衡,金属铝和铁有可能全部剩余,
观察选项,故选C.
点评:本题考查了金属与酸反应与物理知识的结合,完成此题,可以依据物质间反应的化学方程式以及酸过量或金属过量的角度进行.
解答:解:若酸过量,则金属全部参加反应,设金属的质量为54,由铁生成的氢气的质量为x,
2Al+6HCl═2AlCl3+3H2↑
54 6
Fe+2HCl═FeCl2+H2↑
56 2
54 x
 =
=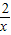
x=1.9
可以看出相同质量的铝和铁与足量的盐酸反应,铝生成的氢气质量比铁多,故天平会指向加铁的一方,
若酸量不足,则酸全部参加反应,相同的酸生成氢气的质量相等,故天平会仍然平衡,金属铝和铁有可能全部剩余,
观察选项,故选C.
点评:本题考查了金属与酸反应与物理知识的结合,完成此题,可以依据物质间反应的化学方程式以及酸过量或金属过量的角度进行.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(2003?济南)某校化学研究性学习课题组的同学为了测定某氢氧化钙样品中Ca(OH)2的质量分数(含有的杂质为CaCO3),共做了三次实验,使一定量的该样品分别与溶质质量分数相同的稀盐酸反应,所得相关实验数据记录如下表:
(1)在第______次实验中,反应容器内有白色固体剩余.
(2)原样品中Ca(OH)2的质量分数为______(精确到0.1%).
(3)经测定第2次实验反应完全后,所得溶液中的溶质只有一种,通过计算求所得溶液中的溶质质量分数为多少?(精确到0.1%)______.
| 第1次 | 第2次 | 第3次 | |
| 所取试样质量 | 17.4g | 17.4g | 17.4g |
| 所取稀盐酸质量 | 80g | 100g | 120g |
| 生成CO2质量 | 2.64g | 4.4g | 4.4g |
(2)原样品中Ca(OH)2的质量分数为______(精确到0.1%).
(3)经测定第2次实验反应完全后,所得溶液中的溶质只有一种,通过计算求所得溶液中的溶质质量分数为多少?(精确到0.1%)______.
(2003?济南)某校化学研究性学习课题组的同学为了测定某氢氧化钙样品中Ca(OH)2的质量分数(含有的杂质为CaCO3),共做了三次实验,使一定量的该样品分别与溶质质量分数相同的稀盐酸反应,所得相关实验数据记录如下表:
(1)在第______次实验中,反应容器内有白色固体剩余.
(2)原样品中Ca(OH)2的质量分数为______(精确到0.1%).
(3)经测定第2次实验反应完全后,所得溶液中的溶质只有一种,通过计算求所得溶液中的溶质质量分数为多少?(精确到0.1%)______.
| 第1次 | 第2次 | 第3次 | |
| 所取试样质量 | 17.4g | 17.4g | 17.4g |
| 所取稀盐酸质量 | 80g | 100g | 120g |
| 生成CO2质量 | 2.64g | 4.4g | 4.4g |
(2)原样品中Ca(OH)2的质量分数为______(精确到0.1%).
(3)经测定第2次实验反应完全后,所得溶液中的溶质只有一种,通过计算求所得溶液中的溶质质量分数为多少?(精确到0.1%)______.
 (2003?济南)中华民族在世界冶金史上曾谱写过辉煌的篇章,如图即为我国东汉晚期所铸的青铜奔马(马踏飞燕).早在2000多年前的西汉时期就有“曾青得铁则化为铜”的记载,从现代化学的观点理解,这句话的涵义是( )
(2003?济南)中华民族在世界冶金史上曾谱写过辉煌的篇章,如图即为我国东汉晚期所铸的青铜奔马(马踏飞燕).早在2000多年前的西汉时期就有“曾青得铁则化为铜”的记载,从现代化学的观点理解,这句话的涵义是( )