题目内容
【题目】(11分)、现实验室有一瓶久置的NaOH溶液,为检验其是否变质,溶液中的溶质是什么,九(五)班同学设计实验并进行验证。
【提出问题】待测液中的溶质是什么?
(1)请你用化学方程式写出NaOH溶液变质的原因:
【提出猜想】
(2)猜想一:NaOH,猜想二:Na2CO3,猜想三:
【设计方案】
(3)实验方案(一):取少量待测溶液于试管中,向其中滴加无色酚酞溶液,若溶液变红,则说明该待测溶液没有变质,猜想一正确。
请你判断该方案是否合理 ,理由是 。
实验方案(二):取少量待测溶液于试管中,向其中滴加几滴稀盐酸,若溶液中没有出现气泡,则说明该待测溶液没有变质了,猜想一正确。小陈同学认为该结论不合理,请你想一想他的理由 。
实验方案(三):取少量待测溶液于试管中,先向其中加入足量的澄清石灰水,再加入无色酚酞,若观察到先有白色沉淀产生,后溶液变红的现象,则说明猜想三正确。请你写出发生的方程式 。小刘同学提出异议,原因是 。
实验方案(四):取少量待测溶液于试管中,先向其中加入足量的BaCl2溶液,再加入无色酚酞,若观察
到 现象,则说明猜想三正确。
【实验结论】该溶液为部分变质的NaOH溶液。
【反思交流】CO2与NaOH溶液反应没有明显现象,除了选用试剂验证产物碳酸钠的存在能证明两者可以反应外,是否有其他办法证明两者反应呢?
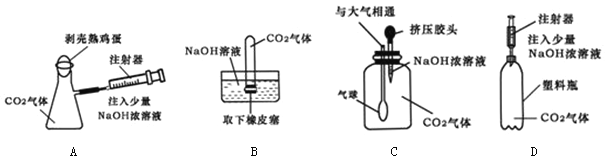
(4)下列四种实验设计,实验中其现象不足以说明CO2与NaOH溶液发生了反应的是 。
【答案】(1)2NaOH + CO2 === Na2CO3 + H2O
(2)Na2CO3和NaOH
(3)不合理,
因为Na2CO3和NaOH溶液都可使酚酞变红
盐酸只加了几滴,若溶液中有NaOH和Na2CO3,NaOH会先于酸反应。要证明一定没有Na2CO3,盐酸应加足量。
Ca(OH)2 + Na2CO3=== CaCO3 ↓ +2NaOH
该反应本身生成2NaOH,且Ca(OH)2过量
先有白色沉淀产生,后溶液变红
(4)B
【解析】
试题分析:(1)氢氧化钠易与空气中的二氧化碳反应生成碳酸钠而变质:2NaOH + CO2 === Na2CO3 + H2O;
(2)氢氧化钠可能没有变质也可能部分变质,还可能全部变质,若没有变质,那么溶质为是氢氧化钠;若部分变质,那么溶质是碳酸钠和氢氧化钠;若是全部变质,溶质是碳酸钠;
(3)实验方案(一)由于氢氧化钠与二氧化碳负生成的碳酸钠也呈碱性,也能使无色的酚酞变成红色,故不能判断氢氧化钠是否变质;
实验方案(二)若氢氧化钠部分变质,那么加入的盐酸先与溶液中的氢氧化钠反应,再与碳酸钠反应,由于加入的盐酸的量过少,故不能判断溶液中是否含有碳酸钠;
实验方案(三)氢氧化钙会与碳酸钠反应生成碳酸钙沉淀和氢氧化钠;由于该反应中会生成氢氧化钠,故若氢氧化钠全部变质了无色的酚酞试液也会变成红色;
实验方案(四)若含有碳酸钠,则氯化钡会与碳酸钠反应生成碳酸钡沉淀和氯化钠,滴加无色酚酞,若酚酞变成红色,说明溶液呈碱性,即含有氢氧化钠,那么说明氢氧化钠是部分变质;
(4)A中若氢氧化钠不能与二氧化碳反应,鸡蛋不能进入到锥形瓶中;B中由于二氧化碳易溶于水,故不管二氧化碳是否与氢氧化钠反应,水都会进入试管中;C中若二氧化碳不能与氢氧化钠反应,那么气球不会变大;D中若二氧化碳不能与氢氧化钠反应软塑料瓶不会变瘪。