题目内容
质量和质量分数均相等的氢氧化钾溶液和稀盐酸相混合后,滴入紫色石蕊试液,溶液呈( )
分析:根据氢氧化钾与盐酸反应的化学方程式和氢氧化钾与盐酸的相对分子质量进行比较,得出完全反应后剩余的是哪一溶液,再根据“紫色石蕊试液遇酸变红色,遇碱变蓝色,遇中性溶液不变色”进行判断.
解答:解:氢氧化钾与盐酸反应的化学方程式为:KOH+HCl=KCl+H2O,KOH的相对分子质量为56,HCl的相对分子质量为36.5,在反应中,参与反应的KOH质量>HCl质量,故等质量、等质量分数的氢氧化钾溶液与盐酸完全反应后,盐酸有剩余,溶液显酸性,故溶液呈现红色.
故选A.
故选A.
点评:本题主要考查学生运用化学方程式进行计算的能力,以及对酸碱指示剂的性质的认识.

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
在实验探究过程中,如果有多种因素同时影响某一实验结果,当我们要探究其中的一种因素时,就要使其他因素保持不变,以探究此种因素对实验结果的影响。下表是稀硫酸与某金属反应的实验数据:
通过分析上述数据得出的结论不正确的是: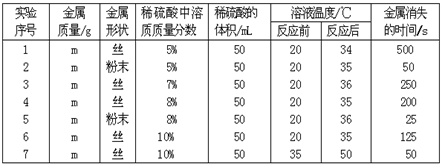
| A.对比实验1和2、4和5,可得出固体反应物的表面积越大,反应越快的结论。 |
| B.表明反应物的溶质质量分数越大,反应越快的只有2和5 |
| C.表明反应体系的温度越高,反应越快的只有6和7。 |
| D.实验中的所有反应,反应前后溶液的温度变化值相近(约15℃),推测其原因是:所有反应中,金属质量和硫酸体积均相等,且金属完全反应,产生热量相等,所以溶液温度变化值相近。 |