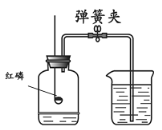
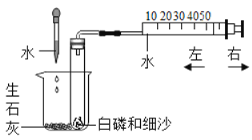
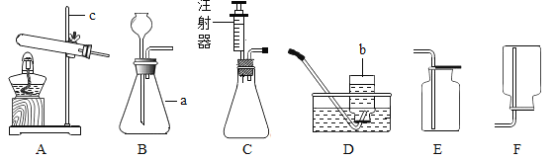
题目内容
【题目】以下是某研究小组探究影响反应速率部分因素的相关实验数据。
实验 序号 | 过氧化氢 溶液浓度/% | 过氧化氢 溶液体积/mL | 温度 /℃ | 二氧化锰 的用量/g | 收集氧气 的体积/ mL | 反应所需 的时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 2 | 49.21 | |
④ | 30 | 5 | 55 | 2 | 10.76 |
(1)通过实验①和②对比可知,化学反应速率与_____有关;从实验③和④对比可知,化学反应速率与温度的关系是__________;
(2)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,则产生氧气的总重量将________(选填“减小、不变或增大”)。
(3)写出实验②中反应的符号表达式:_______________。
如图是某品牌补铁剂的标签。请回答:

(1)富马酸亚铁中C、H元素的质量比为____________;
(2)已知富马酸亚铁(C4H2FeO4)中铁元素的质量分数为33%,若每次服用1包该补铁剂,摄入铁元素的质量为___________mg
【答案】过氧化氢溶液的浓度; 温度越高,反应速率越快 不变 H2O2![]() H2O+O2 24:1 66
H2O+O2 24:1 66
【解析】
(1)对比实验①和②可知,不同的量是过氧化氢溶液的浓度,故填过氧化氢溶液的浓度。
(2)对比实验③和④可知温度越高,反应速率越快,故填温度越高,反应速率越快。
(3)反应物的浓度知影响反应速率,不改变生成物的质量,故填不变。
(4)实验②中的反应是过氧化氢在催化剂的条件下反应生成水和氧气,故符号表达式写为:H2O2![]() H2O+O2。
H2O+O2。
(5)解:富马酸亚铁中C、H元素的质量比为(12×4):(1×2)= 24:1,故填24:1。
(6)解:服用1包该补铁剂摄入铁元素的质量为0.2g×33% = 0.066g = 66mg,故填66mg。