题目内容
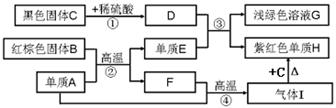
有一包固体粉末,可能含有氧化铁、碳酸钠、碳酸钙、氢氧化钠中的一种或多种,为确定其成分,化学小组的同学设计并进行如下图所示实验,回答下列问题。(提示:CaCl2+Na2CO3=CaCO3↓+2NaCl)
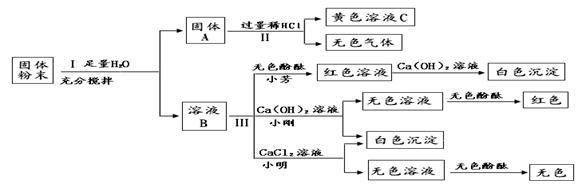
(1)步骤Ⅰ必须进行的操作是 。固体A中含有的物质是 。
(2)步骤Ⅱ中生成气体的化学方程式为 。黄色溶液C中的溶质有 。
(3)步骤Ⅲ几位同学的设计略有不同,根据他们的设计,你推测,固体粉末中含有 。
(4)小丽同学提出:若步骤Ⅲ只用到酚酞,也得出正确的结论,她的方法是 。

(1)步骤Ⅰ必须进行的操作是 。固体A中含有的物质是 。
(2)步骤Ⅱ中生成气体的化学方程式为 。黄色溶液C中的溶质有 。
(3)步骤Ⅲ几位同学的设计略有不同,根据他们的设计,你推测,固体粉末中含有 。
(4)小丽同学提出:若步骤Ⅲ只用到酚酞,也得出正确的结论,她的方法是 。
(1)过滤; CaCO3、Fe2O3
(2)CaCO3+2HCl =" CaCl" 2+CO2↑+H2O ;FeCl3、CaCl2、HCl
(3)碳酸钠;
(4)在进行步骤Ⅰ实验时,用手触摸烧杯壁(或用温度计测量温度),没有热感,说明没有氢氧化钠。
(2)CaCO3+2HCl =" CaCl" 2+CO2↑+H2O ;FeCl3、CaCl2、HCl
(3)碳酸钠;
(4)在进行步骤Ⅰ实验时,用手触摸烧杯壁(或用温度计测量温度),没有热感,说明没有氢氧化钠。
(1)把固体和液体分离;碳酸钙和氧化铁不溶于水,(2)根据固体A和盐酸反应生成黄色液体和气体可知,固体A 中含有碳酸钙和氧化铁,碳酸钙和盐酸生成氯化钙和水,二氧化碳,氧化铁和盐酸生成氯化铁和水
(3)溶液B和氢氧化钙,氯化钙都生成沉淀,所以一定含有碳酸钠;碳酸钠显碱性能使无色酚酞变红,不能确定是不是含有氢氧化钠
(4)根据氢氧化钠溶于水放热碱性解答
(3)溶液B和氢氧化钙,氯化钙都生成沉淀,所以一定含有碳酸钠;碳酸钠显碱性能使无色酚酞变红,不能确定是不是含有氢氧化钠
(4)根据氢氧化钠溶于水放热碱性解答

练习册系列答案
相关题目