题目内容
【题目】为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算: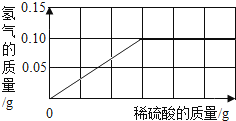
①样品中铜的质量分数;
②反应所消耗的硫酸溶液质量;
③反应后所得溶液质量.
【答案】解:由图象可知反应完全后生成的氢气质量是0.1g
设样品中锌的质量为x;消耗硫酸溶液的质量为y;
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x y×9.8% 0.10g![]()
x=3.25g, y=50g;
①样品中铜的质量分数= ![]() ×100%=67.5%;
×100%=67.5%;
②反应所消耗的硫酸溶液质量为y=50g;
③所得溶液的质量为:3.25g+50g﹣0.1g=53.15g.
【解析】本题主要考查有关化学方程式的计算,难度较大.计算所得溶液质量时,要注意:①不能把铜的质量计算在所得溶液中;②不能把生成氢气的质量计算在所得溶液中.

练习册系列答案
相关题目


