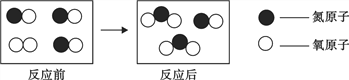
题目内容
【题目】请沿用科学家认识事物的方式认识“空气”。
(1)从分类的角度:空气属于_____(填“混合物”或“纯净物”);
(2)从微观角度:用“![]() ”表示氮原子,用“
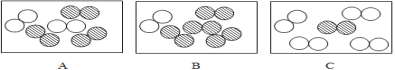
”表示氮原子,用“![]() ”表示氧原子,同温同压下,气体的体积比等于分子数目比,若空气中其他成分忽略不计,下图可以表示空气微观模型的是_____(填标号);
”表示氧原子,同温同压下,气体的体积比等于分子数目比,若空气中其他成分忽略不计,下图可以表示空气微观模型的是_____(填标号);
(3)从变化角度:已知:常压下,氮气沸点-196℃,氧气沸点-183℃。将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是_____。该烧杯放置一段时间后,液态物质剩余约1/10体积,其主要成分是______;
(4)从用途角度:下列有关空气中各成分的用途不正确的是____________(填标号)
A氮气可以制造化肥 B氧气能支持燃烧,可作高能燃料
C稀有气体用作保护气 D食品包装袋中充氮气以防腐
(5)从环保角度:下列保护空气措施合理的有___________(填标号)。
A.工厂通过加高烟囱直接排放废气 B.限制或禁止燃放烟花爆竹
C.提倡步行、骑自行车等“低碳”出行方式 D. 鼓励使用太阳能热水器
【答案】混合物; B 燃着的木条熄灭 液氧 B BCD
【解析】
(1)从分类的角度:空气是由氮气、氧气、二氧化碳、稀有气体等多种物质组成,属于混合物;
(2)从微观角度:同温同压下,气体的体积比等于分子数目比,空气中氮气约占空气体积的78%,氧气占21%,所以氮气分子数目约为氧气分子数目的4倍,可以表示空气微观模型的是B;
(3)从变化角度:已知:常压下,氮气沸点-196℃,氧气沸点-183℃。燃烧是可燃物与氧气充分接触发生的发光、放热的剧烈的氧化反应。燃烧需要同时具备的三个条件:物质有可燃性、温度达可燃物的着火点、与氧气充分接触;灭火时只需要破坏一个条件即可。将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是木条熄灭。原因是①液氮挥发吸热,使可燃物的温度降到着火点以下,②首先挥发出来的是氮气,氮气不可燃、不助燃;空气中各成分的含量按体积分数计算,氮气占78%,氧气占21%,稀有气体占0.94%,二氧化碳占0.03%,分离液态空气制氧气,是利用液氧和液氮的沸点不同,液氮的沸点低,首先蒸发出来,液态物质剩余约十分之一体积,其主要成分是液氧;
(4)从用途角度:
A根据质量守恒定律可知,反应前后元素的种类不变,氮气可以制造化肥,选项正确;
B氧气能支持燃烧,可作助燃剂,氧气不可燃,不能做燃料,选项错误;
C稀有气体化学性质稳定,可用作保护气 ,选项正确;
D氮气化学性质稳定,食品包装袋中填充氮气能隔绝氧气,防止食物因缓慢氧化而变质,选项正确;故选B;
(5)从环保角度:
A.工厂通过加高烟囱直接排放废气,会导致污染空气甚至形成酸雨,选项错误;
B.限制或禁止燃放烟花爆竹,可以减少污染物的排放,有利于保护环境,选项正确;
C.提倡步行、骑自行车等“低碳”出行方式 ,可以减少二氧化碳及污染物的排放,有利于保护环境,选项正确;
D. 鼓励使用太阳能热水器,可以减少污染物的排放,有利于保护环境,选项正确;故选BCD。

【题目】研究和控制化学反应条件有重要意义。
(1)同学们想探究双氧水的浓度对反应速率的影响。在其他条件相同的情况下进行了三次 实验,记录各收集一瓶相同体积氧气所需要的时间。
实验 | 30%双氧水的质量(g) | 加入的水的体积(mL) | 二氧化锰质量(g) | 收集时间(s) |
1 | 10 | 40 | 5 | 200 |
2 | 20 | 30 | 5 | 100 |
3 | 30 | 20 | __________ | 67 |
①写出上述反应的化学反应方程式__________。
②实验3中,加入的二氧化锰质量为__________g。
③该实验中氧气适宜采用__________方法进行收集,根据表中数据的分析,得出如下结论:相同条件下,实验3产生氧气的速率最快,说明__________。
(2)同学通过查阅资料得知,双氧水在70℃以上会较快分解产生氧气。为了验证加热双氧水也可以产生氧气,同学、 们选择如图装置(气密性良好)进行实验。实验中观察到试管内产生气泡,但将带火星的木条放在导管口没有复燃,可能的原因是__________,同学分析原因后,采用了__________法收集气体,再检验,证明加热双氧水也可产生氧气。

【题目】在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如表所示,下列说法不正确的是( )
物质 | X | Y | Z | W |
反应前质量/g | 10 | 3 | 90 | 0 |
反应后质量/g | 3.2 | 3 | 待测 | 3.2 |
A. W可能是单质 B. Y可能是催化剂
C. 该反应是分解反应 D. 反应后Z物质的质量为![]()