题目内容
某同学使用下图所示装置,试验一氧化碳与氧化铜的反应.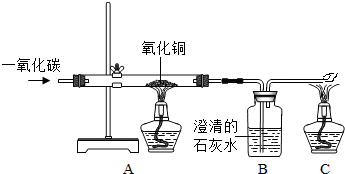
请回答下列有关问题:
(1)有下列实验步骤:①加热;②通入一氧化碳.请用上述实验步骤的标号填空:实验开始时,应先
(2)实验进行一段时间后,A装置中出现的现象为
(3)由上述实验可知,一氧化碳具有
(4)在C处放置燃着的酒精灯,目的是
(5)如用该装置进行一氧化碳高温下与氧化铁的反应,请写出反应的化学方程式
分析:(1)根据可燃性气体在点燃或加热前一定要验纯,如果气体不纯会发生爆炸的知识来作答;
(2)一氧化碳还原氧化铜的反应原理为:CO+CuO
Cu+CO2,据此可推测出实验现象;
(3)在参加化学反应时得到氧元素的物质具有还原性,我们所了解的在化学反应中得到氧元素的物质有:一氧化碳、氢气、碳;
(4)根据CO有毒,排放到空气中会污染空气分析解答;
(5)根据化学变化前后元素质量不变,由炼出含杂质4%的生铁中铁元素质量与100t含氧化铁80%的赤铁矿石中所含铁元素质量相等,计算生成生铁的质量.
(2)一氧化碳还原氧化铜的反应原理为:CO+CuO
| ||
(3)在参加化学反应时得到氧元素的物质具有还原性,我们所了解的在化学反应中得到氧元素的物质有:一氧化碳、氢气、碳;
(4)根据CO有毒,排放到空气中会污染空气分析解答;
(5)根据化学变化前后元素质量不变,由炼出含杂质4%的生铁中铁元素质量与100t含氧化铁80%的赤铁矿石中所含铁元素质量相等,计算生成生铁的质量.
解答:解:(1)由于一氧化碳气体是可燃性气体,所以在点燃前要先通入一氧化碳气体使装置中的空气排净,然后再加热,防止气体不纯,加热时发生爆炸;
(2)一氧化碳还原氧化铜的反应原理为:CO+CuO
Cu+CO2,所以实验进行一段时间后,A装置中出现的现象为:有红色物质出现,说明有单质铜生成;B装置中出现的现象为澄清石灰水变浑浊,说明有二氧化碳生成;
(3)氢气、一氧化碳、单质碳在参加化学反应时得到氧元素,具有还原性;
(4)使用酒精灯把尾气中有毒气体CO燃烧变成二氧化碳,防止尾气污染空气;
(5)氧化铁Fe2O3中铁元素的质量分数=
×100%=70%
100t含氧化铁80%的赤铁矿石中,氧化铁的质量=100t×80%=80t
理论上可以炼出含杂质4%的生铁的质量=
=58.3t
故答案为:(1)②;①
(2)黑色氧化铜变为红色;铜;澄清石灰水变浑浊;二氧化碳
(3)还原;氢气;碳;冶炼金属
(4)使剩余的CO燃烧,避免污染空气
(5)3CO+Fe2O3
2Fe+3CO2; 58.3吨
(2)一氧化碳还原氧化铜的反应原理为:CO+CuO
| ||
(3)氢气、一氧化碳、单质碳在参加化学反应时得到氧元素,具有还原性;
(4)使用酒精灯把尾气中有毒气体CO燃烧变成二氧化碳,防止尾气污染空气;
(5)氧化铁Fe2O3中铁元素的质量分数=
| 56×2 |
| 56×2+16×3 |
100t含氧化铁80%的赤铁矿石中,氧化铁的质量=100t×80%=80t
理论上可以炼出含杂质4%的生铁的质量=
| 80t×70% |
| 1-4% |
故答案为:(1)②;①
(2)黑色氧化铜变为红色;铜;澄清石灰水变浑浊;二氧化碳
(3)还原;氢气;碳;冶炼金属
(4)使剩余的CO燃烧,避免污染空气
(5)3CO+Fe2O3
| ||
点评:在使用可燃性气体进行实验前,一定要检验气体纯度,防止气体不纯而引起爆炸.

练习册系列答案
相关题目

 现有下图所示仪器和装置,请回答下列问题
现有下图所示仪器和装置,请回答下列问题
 G 。
G 。 导入。若使用排水法,水由 端(填“a”或“b”)排出。若用排水法将瓶内的气体导出,水应该从 端通入。
导入。若使用排水法,水由 端(填“a”或“b”)排出。若用排水法将瓶内的气体导出,水应该从 端通入。