题目内容
 油价的持续“高烧”,引发人们对未来能源供需及价格的深切关注,并且促使人们寻求石油的替代品.
油价的持续“高烧”,引发人们对未来能源供需及价格的深切关注,并且促使人们寻求石油的替代品.
(1)下列说法正确的是______(填字母).
A.我们应珍惜化石燃料,因为它们既是燃料,又是重要的化工原料,且不可再生
B.在合理使用化石燃料的同时,我们应努力寻求开发新能源
C.国家决定推广乙醇汽油的应用,乙醇汽油是一种新型化合物
D.汽车使用乙醇汽油能减少有害气体的排放
(2)某同学对乙醇溶液是否呈现酸碱性产生了疑惑,请参与讨论:
[提出问题]乙醇化学式为C2H5OH,含有“氢氧根”,所以猜测它的水溶液应该显碱性.
[实验设计及操作1]取乙醇溶液少量于试管中,滴加紫色石蕊溶液,观察到溶液为______色,则说明乙醇溶液不显碱性.为什么乙醇溶液不呈现碱性呢?
[解释与结论]通过乙醇溶液的导电性实验,可知乙醇溶液几乎不导电.说明乙醇溶液中不含带电的离子,即不含______(写出离子符号),所以乙醇溶液不显碱性.
(3)请写出乙醇在氧气充足时燃烧的化学方程式______.
| 编号 | ① | ② | ③ |
| 装置 | 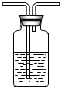 | 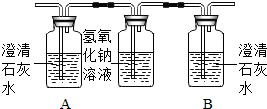 | 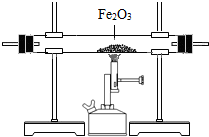 |
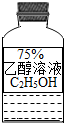
II.装置②中A、B两瓶均盛有澄清的石灰水,其作用分别是______,______;
写出装置①中所盛溶液名称是______,其溶液的作用______.
III.与乙醇结构相似的化合物还有甲醇(CH3OH)、丙醇(C3H7OH)、丁醇(C4H9OH)…等,这类物质称为醇类,则一个分子中含8个碳原子的醇的化学式为______.
(4)将一定量的乙醇和氧气置于一个完全封闭的容器中引燃,测得反应前后各物质的质量如下表:
| 物 质 | 乙醇 | 氧气 | 二氧化碳 | 水 | 一氧化碳 |
| 反应前质量/g | 4.6 | 8 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 4.4 | 5.4 | m |
解:(1)A、我们应珍惜化石燃料,因为它们既是燃料,又是重要的化工原料,且不可再生,正确.
B、在合理使用化石燃料的同时,我们应努力寻求开发新能源,正确.
C、乙醇汽油属于混合物,不正确.
D、乙醇油燃烧时能生成二氧化碳和水,能减少有害气体的排放,正确.
故选ABD.
(2)因为碱能使紫色石蕊试液变蓝,根据结论乙醇溶液不显碱性,所以不变色,仍然为紫色;由于氢氧根带一个单位负电荷,所以符号为OH-;
(3)乙醇在氧气充足时,燃烧的化学方程式是:C2H5OH+3O2 2CO2+3H2O.
2CO2+3H2O.
I.先通过澄清石灰水如果变浑浊,说明有二氧化碳,再用氢氧化钠把二氧化碳除尽,再通过澄清石灰水看二氧化碳是否被除尽,再通过氧化铁,看是否能再产生二氧化碳;
II.A证明乙醇燃烧的产物中有二氧化碳,是为了验证是否有二氧化碳,B证明乙醇燃烧产物中的二氧化碳是否被氢氧化钠溶液完全吸收.完全除尽后才能再检验通过氧化铁是否有新的二氧化碳生成;
III.根据观察可知规律为CnH2n+1OH,所以8个碳原子的醇的化学式就是把n换成8,所以化学式为C8H17OH.
(4)根据质量守恒定律,参加反应的乙醇和氧气的和是:4.6克+8克=12.6克,生成的水和二氧化碳的质量和为:5.4克+4.4克=9.8克,则生成的一氧化碳的质量为12.6克-9.8克=2.8克;根据表中的数据和物质可知,此反应的反应物是乙醇和氧气,反应条件是点燃,生成物是二氧化碳、水、一氧化碳,可知应该是:C2H5OH+O2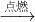 CO2+H2O+CO,根据各物质的量和各自的质量可知:
CO2+H2O+CO,根据各物质的量和各自的质量可知:
C2H5OH+O2 CO2+H2O+CO,
CO2+H2O+CO,
46 32 44 18 28
4.6g 8g 4.4g 5.4g 2.8g
可见C2H5OH、CO2、CO前的系数是相同的,物质的量和质量之间的比是10:1,所以O2和H2O的物质的量和质量之间的比也应该是10:1,通过计算可知它们化学方程式是:2C2H5OH+5O2 2CO2+6H2O+2CO.
2CO2+6H2O+2CO.
故答案为:
(1)ABD;
(2)紫(或不变色);OH-
(3)C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O
I.②③①,没有尾气处理装置.
II.A证明乙醇燃烧的产物中有二氧化碳; B证明二氧化碳是否被氢氧化钠溶液完全吸收.
澄清的石灰水; 证明③中反应有二氧化碳生成,从而说明燃烧产物中有一氧化碳.
III.C8H17OH
(4)2.8; 2C2H5OH+5O2 2CO2+6H2O+2CO.
2CO2+6H2O+2CO.
分析:(1)根据化合物的判断方法考虑;
(2)利用酸碱指示剂检验乙醇是否显碱性;
(3)根据反应物、反应条件、生成物写出化学方程式;
I.根据先验证二氧化碳的存在方法,再验证一氧化碳的方法考虑;根据一氧化碳具有污染性考虑本题;II,根据先检验是否存在二氧化碳,再看是否被除尽考虑;通过把原来的二氧化碳除尽再通过氧化铁再生成二氧化碳来判断是否存在一氧化碳;根据碳和氢的原子个数来找出关系.
(4)根据质量守恒定律,参加反应的乙醇和氧气的和是:4.6克+8克=12.6克,生成的水和二氧化碳的质量和为:5.4克+4.4克=9.8克,则生成的一氧化碳的质量为12.6克-9.8克=2.8克;根据反应物、反应条件、生成物写出化学方程式.
点评:解答本题容易出错的地方是检验一氧化碳时必须先将原来的二氧化碳除去,为了检验是否被除尽,通过澄清石灰水看是否变浑浊,要明确题目中三个地方用到澄清石灰水的作用.
B、在合理使用化石燃料的同时,我们应努力寻求开发新能源,正确.
C、乙醇汽油属于混合物,不正确.
D、乙醇油燃烧时能生成二氧化碳和水,能减少有害气体的排放,正确.
故选ABD.
(2)因为碱能使紫色石蕊试液变蓝,根据结论乙醇溶液不显碱性,所以不变色,仍然为紫色;由于氢氧根带一个单位负电荷,所以符号为OH-;
(3)乙醇在氧气充足时,燃烧的化学方程式是:C2H5OH+3O2
 2CO2+3H2O.
2CO2+3H2O.I.先通过澄清石灰水如果变浑浊,说明有二氧化碳,再用氢氧化钠把二氧化碳除尽,再通过澄清石灰水看二氧化碳是否被除尽,再通过氧化铁,看是否能再产生二氧化碳;
II.A证明乙醇燃烧的产物中有二氧化碳,是为了验证是否有二氧化碳,B证明乙醇燃烧产物中的二氧化碳是否被氢氧化钠溶液完全吸收.完全除尽后才能再检验通过氧化铁是否有新的二氧化碳生成;
III.根据观察可知规律为CnH2n+1OH,所以8个碳原子的醇的化学式就是把n换成8,所以化学式为C8H17OH.
(4)根据质量守恒定律,参加反应的乙醇和氧气的和是:4.6克+8克=12.6克,生成的水和二氧化碳的质量和为:5.4克+4.4克=9.8克,则生成的一氧化碳的质量为12.6克-9.8克=2.8克;根据表中的数据和物质可知,此反应的反应物是乙醇和氧气,反应条件是点燃,生成物是二氧化碳、水、一氧化碳,可知应该是:C2H5OH+O2
 CO2+H2O+CO,根据各物质的量和各自的质量可知:
CO2+H2O+CO,根据各物质的量和各自的质量可知:C2H5OH+O2
 CO2+H2O+CO,
CO2+H2O+CO,46 32 44 18 28
4.6g 8g 4.4g 5.4g 2.8g
可见C2H5OH、CO2、CO前的系数是相同的,物质的量和质量之间的比是10:1,所以O2和H2O的物质的量和质量之间的比也应该是10:1,通过计算可知它们化学方程式是:2C2H5OH+5O2
 2CO2+6H2O+2CO.
2CO2+6H2O+2CO.故答案为:
(1)ABD;
(2)紫(或不变色);OH-
(3)C2H5OH+3O2
 2CO2+3H2O
2CO2+3H2OI.②③①,没有尾气处理装置.
II.A证明乙醇燃烧的产物中有二氧化碳; B证明二氧化碳是否被氢氧化钠溶液完全吸收.
澄清的石灰水; 证明③中反应有二氧化碳生成,从而说明燃烧产物中有一氧化碳.
III.C8H17OH
(4)2.8; 2C2H5OH+5O2
 2CO2+6H2O+2CO.
2CO2+6H2O+2CO.分析:(1)根据化合物的判断方法考虑;
(2)利用酸碱指示剂检验乙醇是否显碱性;
(3)根据反应物、反应条件、生成物写出化学方程式;
I.根据先验证二氧化碳的存在方法,再验证一氧化碳的方法考虑;根据一氧化碳具有污染性考虑本题;II,根据先检验是否存在二氧化碳,再看是否被除尽考虑;通过把原来的二氧化碳除尽再通过氧化铁再生成二氧化碳来判断是否存在一氧化碳;根据碳和氢的原子个数来找出关系.
(4)根据质量守恒定律,参加反应的乙醇和氧气的和是:4.6克+8克=12.6克,生成的水和二氧化碳的质量和为:5.4克+4.4克=9.8克,则生成的一氧化碳的质量为12.6克-9.8克=2.8克;根据反应物、反应条件、生成物写出化学方程式.
点评:解答本题容易出错的地方是检验一氧化碳时必须先将原来的二氧化碳除去,为了检验是否被除尽,通过澄清石灰水看是否变浑浊,要明确题目中三个地方用到澄清石灰水的作用.

练习册系列答案
相关题目
 (2012?邗江区二模)油价的持续“高烧”,引发人们对未来能源供需及价格的深切关注,并且促使人们寻求石油的替代品.
(2012?邗江区二模)油价的持续“高烧”,引发人们对未来能源供需及价格的深切关注,并且促使人们寻求石油的替代品.


 (2012?溧水县一模)油价的持续“高烧”,引发人们对未来能源供需及价格的深切关注,并且促使人们寻求石油的替代品.
(2012?溧水县一模)油价的持续“高烧”,引发人们对未来能源供需及价格的深切关注,并且促使人们寻求石油的替代品.

