题目内容
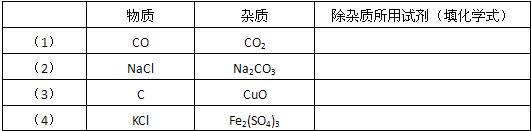
请分别用一种试剂除去下列各物质中的杂质(假设所选试剂与杂质恰好完全反应).| 物质 | 杂质 | 除杂质所用的试剂(填化学式) | |
| (1) | CO | CO2 | |
| (2) | NaCl | Na2CO3 | |
| (3) | C | CuO | |
| (4) | KCl | Fe2(SO4)3 |
【答案】分析:题目是除去杂质,要求选择出相应的试剂,要求是书写该试剂的化学式.首先要根据杂质和主要成分的性质特点来选择合适的试剂,如CO中混有CO2,由于CO2显酸性且能够溶解于水,所以可以借助水或者碱性溶液来实现,之后就选择一个相对更合理的试剂,如水中二氧化碳溶解度较小,而碱性物质中氢氧化钙的溶解度很小,所以用来除去杂质二氧化碳就相对困难,所以就选择溶解度较大的NaOH或者KOH等.
解答:解:
(1)主要成分是CO,杂质是CO2.由于CO2明显显酸性,且能够溶解于水,而CO物酸性,难溶于水.所以就可以考虑将混合气体通入水或者碱性溶液中,由于CO2在水中溶解度较小,同样碱性物质中氢氧化钙的溶解度也很小,所以采用溶解度较大的NaOH或者KOH更合适(氢氧化钙适合于检验CO2,而氢氧化钠和氢氧化钾适合于吸收或者除去CO2).所以选择NaOH或者KOH等.
(2)主要成分是NaCl,杂质是Na2CO3 .主要成分和杂质的阳离子都是钠离子,而阴离子不同,所以除杂时要想办法把把杂质中的CO32-换成Cl-,即加入试剂用的阴离子是Cl-,而阳离子和能够将CO32-转化为气体或者是沉淀.如果采取转化为气体的办法,可以加入适量的稀盐酸;如果采取转化为沉淀,则可以考虑加入适量的CaCl2溶液或者是BaCl2溶液.所以可以是HCl或者CaCl2或者BaCl 2.
(3)主要成分是C,杂质是CuO.两者都不溶于水,且在加热时两者之间能够反应,所以以上两方法均不能采用.而氧化铜能够和硫酸等酸反应转化为溶液,所以可以采用酸与之反应的方法.CuO+H2SO4=CuSO4+H2O,CuO+2HCl=CuCl2+H2O.故硫酸、盐酸均可以.
(4)主要成分是KCl,杂质是Fe2(SO4)3.主要成分和杂质没有共同的部分,所以在除杂时需要将杂质中阴阳离子分别转化为沉淀或者是气体,而根据杂质的阴阳离子,我们知道不可能转化为气体(含铁物质没有气体,含硫酸根的物质也没有气体),只能转化为沉淀.硫酸根对应的沉淀有BaSO4或者Ag2SO4甚至CaSO4,加入溶液的阳离子可以是Ba2+或者Ag+或者是Ca2+.而Fe3+对应的沉淀有Fe2(CO3)2、Fe(OH)3.由于是和盐反应,根据复分解反应规则,当和盐反应时,除非是酸和盐反应,其他物质与盐发生复分解反应时两种物质必须都能够溶解于水,由于BaCO3、CaCO3、Ag2CO3都不溶于水,所以选用的试剂一定不能是碳酸盐.即加入的试剂只能是碱,而AgOH在水中不存在,Ca(OH)2溶解度很小,所以就只能采用能够溶解于水的Ba(OH)2溶液.
故答案:(1)NaOH(2)HCl(3)H2SO4(4)Ba(OH)2(其它答案合理也给分)
点评:对于阴阳离子都不同的杂质的除去,一定要结合阴阳离子对应的物质综合分析可能选择的物质,要结合反应的条件等来慎重选择.
解答:解:
(1)主要成分是CO,杂质是CO2.由于CO2明显显酸性,且能够溶解于水,而CO物酸性,难溶于水.所以就可以考虑将混合气体通入水或者碱性溶液中,由于CO2在水中溶解度较小,同样碱性物质中氢氧化钙的溶解度也很小,所以采用溶解度较大的NaOH或者KOH更合适(氢氧化钙适合于检验CO2,而氢氧化钠和氢氧化钾适合于吸收或者除去CO2).所以选择NaOH或者KOH等.
(2)主要成分是NaCl,杂质是Na2CO3 .主要成分和杂质的阳离子都是钠离子,而阴离子不同,所以除杂时要想办法把把杂质中的CO32-换成Cl-,即加入试剂用的阴离子是Cl-,而阳离子和能够将CO32-转化为气体或者是沉淀.如果采取转化为气体的办法,可以加入适量的稀盐酸;如果采取转化为沉淀,则可以考虑加入适量的CaCl2溶液或者是BaCl2溶液.所以可以是HCl或者CaCl2或者BaCl 2.
(3)主要成分是C,杂质是CuO.两者都不溶于水,且在加热时两者之间能够反应,所以以上两方法均不能采用.而氧化铜能够和硫酸等酸反应转化为溶液,所以可以采用酸与之反应的方法.CuO+H2SO4=CuSO4+H2O,CuO+2HCl=CuCl2+H2O.故硫酸、盐酸均可以.
(4)主要成分是KCl,杂质是Fe2(SO4)3.主要成分和杂质没有共同的部分,所以在除杂时需要将杂质中阴阳离子分别转化为沉淀或者是气体,而根据杂质的阴阳离子,我们知道不可能转化为气体(含铁物质没有气体,含硫酸根的物质也没有气体),只能转化为沉淀.硫酸根对应的沉淀有BaSO4或者Ag2SO4甚至CaSO4,加入溶液的阳离子可以是Ba2+或者Ag+或者是Ca2+.而Fe3+对应的沉淀有Fe2(CO3)2、Fe(OH)3.由于是和盐反应,根据复分解反应规则,当和盐反应时,除非是酸和盐反应,其他物质与盐发生复分解反应时两种物质必须都能够溶解于水,由于BaCO3、CaCO3、Ag2CO3都不溶于水,所以选用的试剂一定不能是碳酸盐.即加入的试剂只能是碱,而AgOH在水中不存在,Ca(OH)2溶解度很小,所以就只能采用能够溶解于水的Ba(OH)2溶液.
故答案:(1)NaOH(2)HCl(3)H2SO4(4)Ba(OH)2(其它答案合理也给分)
点评:对于阴阳离子都不同的杂质的除去,一定要结合阴阳离子对应的物质综合分析可能选择的物质,要结合反应的条件等来慎重选择.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
(09眉山)请分别用一种试剂除去下列各物质中的杂质(假设所选试剂与杂质恰好完全反应)。
|
| 物质 | 杂质 | 除杂质所用试剂(填化学式) |
| (1) | CO | CO2 |
|
| (2) | NaCl | Na2CO3 |
|
| (3) | C | CuO |
|
| (4) | KCl | Fe2(SO4)3 |
|
请分别用一种试剂除去下列各物质中的杂质(假设所选试剂与杂质恰好完全反应)。
| 物质 | 杂质 | 除杂质所用试剂(填化学式) | |
| (1) | CO | CO2 | |
| (2) | NaCl | Na2CO3 | |
| (3) | C | CuO | |
| (4) | KCl | Fe2(SO4)3 |