题目内容
【题目】如图所示为硝酸钾和氯化钠两种物质的饱和溶液的质量分数随温度变化的曲线,M、N分别是50℃时硝酸钾和氯化钠质量分数随温度变化曲线上的点.分析曲线得到的以下结论中,正确的是( )
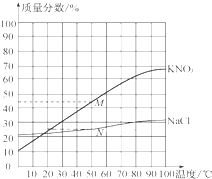
A.50℃时,其他条件不变,降温至40℃,N点向左平移,氯化钠的溶解度降低
B.50℃时,向两饱和溶液添加溶质,M和N点竖直向上移动,硝酸钾和氯化钠的溶解度不变
C.50℃时,M、N之间任一点表示的溶液一定是硝酸钾和氯化钠的饱和溶液
D.50℃时,其他条件不变,升温至60℃,M点向右平移,硝酸钾的溶解度增大
【答案】ABD
【解析】A、氯化钠的溶解度随温度的降低而减小,50℃时,其他条件不变,降温至40℃,N点向左平移,氯化钠的溶解度减小,故A正确;
B、50℃时,向两饱和溶液添加溶质,M和N点竖直向上移动,硝酸钾和氯化钠的溶解度不变,故B正确;
C、溶解度曲线下面的点,表示该温度下此物质的不饱和溶液,曲线上面的点,表示该温度下,此物质的饱和溶液;因此50℃时,M、N之间任一点表示的溶液一定是硝酸钾的不饱和溶液,是氯化钠的饱和溶液,故C错误;
D、硝酸钾的溶解度随温度的升高而增大,因此50℃时,其他条件不变,升温至60℃,M点向右平移,硝酸钾的溶解度增大,故D正确.
故选:ABD.

【题目】某化学小组在课外活动时做了一个实验,在甲试管中装入某固体物质,乙试管装入某溶液,按如图所示组装好仪器(图中铁架台等仪器已略去).打开止水夹,同时通过分液漏斗加入足量稀盐酸,看到乙试管溶液中有气泡冒出,一段时间后,再关闭止水夹,发现乙中溶液变白色浑浊.符合此实验现象的一组试剂是( )
选项 | 甲中固体 | 乙中溶液 |
A | CaCO3 | Ca(OH)2 |
B | CuCO3 | NaOH |
C | Mg | AgNO3 |
D | KOH | BaCl2 |

A.A B.B C.C D.D
【题目】化学兴趣课上,同学们对过氧化钠(Na2O2)可以做供氧剂产生了浓厚兴趣,于是在老师的指导下展开了以下探究活动。
【提供资料】① 二氧化碳与过氧化钠反应生成氧气和另一种物质.
② 碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)与盐酸反应均能生成CO2.
③ 2Na2O2 + 2H2O === 4NaOH + O2↑.
(1)证明二氧化碳与过氧化钠反应产生氧气并收集一瓶氧气。
同学们在老师的指导下设计了如下图所示的装置。

① 证明氧气已经收集满的方法是 。
② 氢氧化钠溶液的作用是除去未反应的二氧化碳,澄清石灰水的作用是 。
(2)探究二氧化碳与过氧化钠反应生成的另一种物质。
【猜想与假设】下面是同学们提出的3种猜想。
猜想1:是氢氧化钠 猜想2:是碳酸氢钠 猜想3:是碳酸钠
通过对反应物中有关元素的组成分析,你认为猜想 是不正确的,理由是 。
【进行实验】同学们通过以下实验验证了另一种物质,请完成下述实验报告。
|
【反思与评价】若将人呼出的气体通过上图装置,也可以证明二氧化碳与过氧化钠反应
生成了氧气,你是否同意这种做法,请说明你的观点并阐述理由 。