题目内容
“用微观的眼光看世界”是我们学习化学的重要思想方法,回答下列问题:
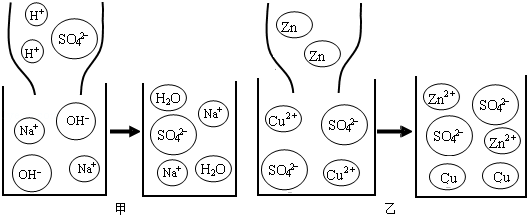
(1)稀硫酸和氢氧化钠溶液发生反应的微观过程如图甲所示.从微观角度分析该反应的实质 ;
(2)图乙所示属基本反应类型中的 反应;
(3)图甲中为了准确控制反应的进度,可先向氢氧化钠溶液中加入几滴无色酚酞溶液,当二者恰好完全反应时,溶液的颜色变化是 ,此时溶液中存在的粒子是 ;
(4)40克固态的氢氧化钠配制成溶液后,能与245克稀硫酸恰好完全反应,则稀硫酸的溶质质量分数是 。
(1)H+与OH﹣反应生成H2O分子;(2)置换;(3)由红色变成无色,Na+、SO42﹣;(4)20%
【解析】
试题分析:(1)分析变化前后的微观过程图,从粒子的角度解释所发生的变化原因,并总结成规律。变化前的微粒有:H+、SO42﹣、Na+、OH﹣,而反应后的微粒有:H2O、SO42﹣、Na+,则可判断该反应的实质是:H+与OH﹣反应生成H2O分子;
(2)根据图乙分析反应的特点.判断反应的类型。由图乙可知,该反应是单质和化合物反应生成新的单质和化合物的反应,属于置换反应;
(3)根据酚酞溶液在不同的酸碱性的溶液中的变色分析,观察图甲中存在的离子。当氢氧化钠溶液与稀硫酸恰好完全反应时,溶液呈中性,所以,溶液的颜色变化是由红色变成无色,此时溶液中存在的粒子是Na+、SO42﹣;
(4)根据氢氧化钠与稀硫酸的反应,由氢氧化钠的质量求出稀硫酸中溶质的质量,再求出稀硫酸的溶质质量分数。设该稀硫酸中溶质的质量为x,则
2NaOH+H2SO4=Na2SO4 +2H2O
80 98
40g x
 =
=
解得:x=49g
稀硫酸的溶质质量分数是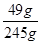 ×100%=20%
×100%=20%
考点:考查微粒观点及模型图的应用;有关溶质质量分数的简单计算;根据化学反应方程式的计算

 阅读快车系列答案
阅读快车系列答案 表示
表示 ”表示一个氮原子,则“
”表示一个氮原子,则“ ”表示
”表示 表示
表示 ,则碘元素在元素周期表中位于第
,则碘元素在元素周期表中位于第 ”表示一个氮原子,则“
”表示一个氮原子,则“ ”表示
”表示
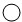 表示氧原 子,
表示氧原 子, 表示氢原子写出该反应的化学方程式:
表示氢原子写出该反应的化学方程式: