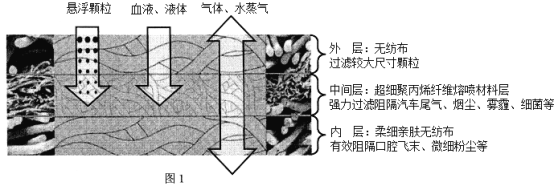
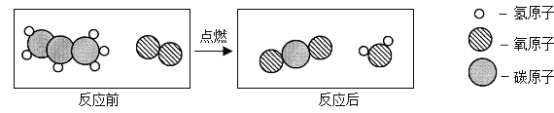
题目内容
【题目】将一定量的锌粉加入到硝酸铝、硝酸铜、硝酸银的混合溶液中。充分反应后过滤。则所得溶液的质量与原混合溶液的质量相等。
(1)滤渣中一定含有:____。
(2)写出可能发生的一个化学方程式___。
【答案】Ag、Cu ![]() 或
或![]() 或
或![]()
【解析】
根据金属活动性顺序表,活动性强的金属放入活动性弱的金属的混合盐溶液中,活动性强的金属会先把活动性最弱的金属从其盐溶液中置换出来,然后再置换活动性较弱的金属,即锌在混合溶液中先跟硝酸银、再跟硝酸铜发生置换反应,不能与硝酸铝反应,在硝酸银过量的情况下,被置换出的铜也可以与硝酸银发生置换反应。
(1)根据质量守恒定律,参加反应的各物质的质量总和等于反应后生成各物质的质量总和。先依据化学方程式分析溶液质量的变化情况:
①![]() ,溶液中参加反应的硝酸银比生成的硝酸锌质量大,因此溶液质量减少;
,溶液中参加反应的硝酸银比生成的硝酸锌质量大,因此溶液质量减少;
②![]() ,溶液中参加反应的硝酸铜比生成的硝酸锌质量小,因此溶液质量增加;
,溶液中参加反应的硝酸铜比生成的硝酸锌质量小,因此溶液质量增加;
③![]() ,溶液中参加反应的硝酸银比生成的硝酸铜质量大,也会导致溶液质量减少;
,溶液中参加反应的硝酸银比生成的硝酸铜质量大,也会导致溶液质量减少;
要使所得溶液的质量与原混合溶液的质量相等,必然存在②,因此一定有Cu析出,根据分析,锌会先置换出溶液中的银;③即使发生,由于会使溶液质量减少,也会有铜剩余,因此滤渣中一定有银和铜,故填:Ag、Cu;
(2)根据分析可以写出3个方程式,锌在混合溶液中先跟硝酸银、再跟硝酸铜发生置换反应,不能与硝酸铝反应,在硝酸银过量的情况下,被置换出的铜也可以与硝酸银发生置换反应,故填:![]() 或
或![]() 或
或![]() 。
。

练习册系列答案
相关题目
【题目】下列除杂所选用试制与操作方法均正确的是
选项 | 物质 | 除杂试剂及操作 |
A |
| 加水溶解、过滤、蒸发结晶 |
B |
| 加入过量稀盐酸,蒸发结晶 |
C |
| 加入过量 |
D |
| 通入灼热的CuO |
A.AB.BC.CD.D