题目内容
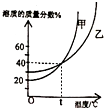
 如图表示甲、乙两种固体(均不含结晶水)物质饱和溶液的溶质质量分数随温度变化的曲线,现分别向50g甲、80g乙固体中各加入150g水,并加热至完全溶解,同时各蒸发掉50g水,下列分析正确的是
如图表示甲、乙两种固体(均不含结晶水)物质饱和溶液的溶质质量分数随温度变化的曲线,现分别向50g甲、80g乙固体中各加入150g水,并加热至完全溶解,同时各蒸发掉50g水,下列分析正确的是
- A.冷却至t℃时,甲、乙两种溶液的溶质质量分数相等
- B.冷却至t℃时,甲、乙均有晶体析出
- C.冷却到0℃时,乙析出的晶体多
- D.0℃时,甲的溶解度大于乙
C
分析:根据题意,加水150克,加热溶解,同时蒸发掉50克水,这一系列变化后,相当于在用150g-50g=100g水分别去溶解50克甲和80克乙固体,可结合物质的饱和溶液的溶质质量分数随温度变化曲线判断降温时的溶解情况;可根据饱和溶液的溶质质量分数随温度变化的曲线,算出t℃两物质的溶解度,然后判断此时100g水所能溶解两种物质的最大值,并进行分析判断.
解答:首先计算t℃时A、B两物质的溶解度:根据饱和溶液的溶质质量分数随温度变化的曲线,t℃时甲、乙两物质的饱和溶液的溶质质量分数相等都为40%,根据饱和溶液的溶质质量分数计算式: ×100%,可知此时两物质的溶解度相等,都为
×100%,可知此时两物质的溶解度相等,都为 ×100g≈67g;
×100g≈67g;
A、t℃时甲、乙两物质的溶解度为67g,即此时100g水最多溶解甲、乙物质的质量都为67g,所以,加入的50g甲可以全部溶解且形成不饱和溶液,加入的80g乙不能全部溶解而成为饱和溶液,因此两溶液的溶质质量分数不相等;故错误;
B、综合以上分析,当降温到t℃时固体甲不会析出,而固体乙物质会析出,故错误;
C、同理,可计算出0℃时甲的溶解度是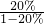 ×100g=25g,乙的溶解度是
×100g=25g,乙的溶解度是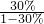 ×100g=50g,所以当降温到0℃时析出甲的质量是50g-25g=25g,析出乙的质量是80g-50g=30g,故C正确;
×100g=50g,所以当降温到0℃时析出甲的质量是50g-25g=25g,析出乙的质量是80g-50g=30g,故C正确;
D、据C分析可知,0℃时甲的溶解度小于乙,故错误;
故选C.
点评:解答本题时需要注意到所给出的曲线不是溶解度曲线,而是饱和溶液的溶质质量分数随温度变化的曲线,可以使用饱和溶液中溶质质量分数与溶解度的关系进行数值转换,要认真分析才能得出正确的答案.
分析:根据题意,加水150克,加热溶解,同时蒸发掉50克水,这一系列变化后,相当于在用150g-50g=100g水分别去溶解50克甲和80克乙固体,可结合物质的饱和溶液的溶质质量分数随温度变化曲线判断降温时的溶解情况;可根据饱和溶液的溶质质量分数随温度变化的曲线,算出t℃两物质的溶解度,然后判断此时100g水所能溶解两种物质的最大值,并进行分析判断.
解答:首先计算t℃时A、B两物质的溶解度:根据饱和溶液的溶质质量分数随温度变化的曲线,t℃时甲、乙两物质的饱和溶液的溶质质量分数相等都为40%,根据饱和溶液的溶质质量分数计算式:
 ×100%,可知此时两物质的溶解度相等,都为
×100%,可知此时两物质的溶解度相等,都为 ×100g≈67g;
×100g≈67g;A、t℃时甲、乙两物质的溶解度为67g,即此时100g水最多溶解甲、乙物质的质量都为67g,所以,加入的50g甲可以全部溶解且形成不饱和溶液,加入的80g乙不能全部溶解而成为饱和溶液,因此两溶液的溶质质量分数不相等;故错误;
B、综合以上分析,当降温到t℃时固体甲不会析出,而固体乙物质会析出,故错误;
C、同理,可计算出0℃时甲的溶解度是
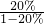 ×100g=25g,乙的溶解度是
×100g=25g,乙的溶解度是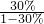 ×100g=50g,所以当降温到0℃时析出甲的质量是50g-25g=25g,析出乙的质量是80g-50g=30g,故C正确;
×100g=50g,所以当降温到0℃时析出甲的质量是50g-25g=25g,析出乙的质量是80g-50g=30g,故C正确;D、据C分析可知,0℃时甲的溶解度小于乙,故错误;
故选C.
点评:解答本题时需要注意到所给出的曲线不是溶解度曲线,而是饱和溶液的溶质质量分数随温度变化的曲线,可以使用饱和溶液中溶质质量分数与溶解度的关系进行数值转换,要认真分析才能得出正确的答案.

练习册系列答案
相关题目
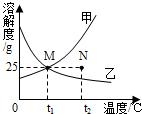
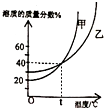 如图表示甲、乙两种固体(均不含结晶水)物质饱和溶液的溶质质量分数随温度变化的曲线,现分别向50g甲、80g乙固体中各加入150g水,并加热至完全溶解,同时各蒸发掉50g水,下列分析正确的是( )
如图表示甲、乙两种固体(均不含结晶水)物质饱和溶液的溶质质量分数随温度变化的曲线,现分别向50g甲、80g乙固体中各加入150g水,并加热至完全溶解,同时各蒸发掉50g水,下列分析正确的是( )