题目内容
附加题:车用乙醇汽油是将乙醇(C2H5OH)与汽油(以C8H18表示)按一定比例混合而成的一种汽车燃料.(1)乙醇分子中,组成元素的原子个数比C:H:O为______.
(2)在密闭容器中,将少量乙醇置于一定量氧气中燃烧,生成二氧化碳、水蒸气和一种未知物质W.现测得反应前后各物质的质量如下:
| 物质 | 乙醇 | 氧气 | 二氧化碳 | 水蒸气 | W |
| 反应前质量/g | 23 | 40 | |||
| 反应后质量/g | 22 | 27 | x |
②根据表中数据,可确定未知物W中各组成元素的质量比为______;
(3)通常可燃物中碳元素质量分数越高,燃烧产生W越多.则相同条件下,乙醇和汽油分别燃烧时,产生W较多的是______;为了使乙醇汽油燃烧过程中少产生W,应采取的措施是(任写一种)______.
【答案】分析:(1)由乙醇的化学式可以得到乙醇中各元素的原子个数比.
(2)①根据质量守恒定律中物质质量守恒可以计算出x的值;
②根据质量守恒定律中元素种类不变、元素质量不变可以计算出W的组成元素和元素质量比.
(3)汽油中碳元素的质量分数比乙醇中的大,因此,相同条件下分别燃烧汽油比乙醇生成较多的W;
可以通过增大氧气量(或提高乙醇在乙醇汽油中的比例等)等措施减少乙醇汽油燃烧过程中W的产生.
解答:解:(1)乙醇中碳、氢、氧的原子个数比为2:6:1
(2)①x的值为
23+40-22-27=14
②23g乙醇中碳、氢、氧三种元素的质量分别为
23g×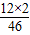 =12g、23g×
=12g、23g×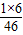 =3g、23g×
=3g、23g×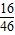 =8g
=8g
22g二氧化碳中碳、氧两种元素的质量分别为
22g×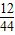 =6g、22g×
=6g、22g×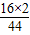 =16g
=16g
27g水中氢、氧两种元素的质量分别为
27g×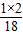 =3g、27g×
=3g、27g×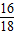 =24g
=24g
12g-6g=6g,说明W中含有6g碳元素;
8g+40g-16g-24g=8g,说明W中含有8g氧元素.
因此W中碳、氧两种元素的质量比为
6g:8g=3:4
(3)汽油中碳元素的质量分数比乙醇中的大,因此,相同条件下分别燃烧汽油比乙醇生成较多的W;
可以通过增大氧气量(或提高乙醇在乙醇汽油中的比例等)等措施减少乙醇汽油燃烧过程中W的产生.
点评:本题主要考查质量守恒定律和有关化学式的计算,难度较大.
(2)①根据质量守恒定律中物质质量守恒可以计算出x的值;
②根据质量守恒定律中元素种类不变、元素质量不变可以计算出W的组成元素和元素质量比.
(3)汽油中碳元素的质量分数比乙醇中的大,因此,相同条件下分别燃烧汽油比乙醇生成较多的W;
可以通过增大氧气量(或提高乙醇在乙醇汽油中的比例等)等措施减少乙醇汽油燃烧过程中W的产生.
解答:解:(1)乙醇中碳、氢、氧的原子个数比为2:6:1
(2)①x的值为
23+40-22-27=14
②23g乙醇中碳、氢、氧三种元素的质量分别为
23g×
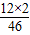 =12g、23g×
=12g、23g×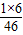 =3g、23g×
=3g、23g×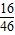 =8g
=8g22g二氧化碳中碳、氧两种元素的质量分别为
22g×
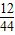 =6g、22g×
=6g、22g×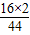 =16g
=16g27g水中氢、氧两种元素的质量分别为
27g×
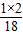 =3g、27g×
=3g、27g×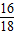 =24g
=24g12g-6g=6g,说明W中含有6g碳元素;
8g+40g-16g-24g=8g,说明W中含有8g氧元素.
因此W中碳、氧两种元素的质量比为
6g:8g=3:4
(3)汽油中碳元素的质量分数比乙醇中的大,因此,相同条件下分别燃烧汽油比乙醇生成较多的W;
可以通过增大氧气量(或提高乙醇在乙醇汽油中的比例等)等措施减少乙醇汽油燃烧过程中W的产生.
点评:本题主要考查质量守恒定律和有关化学式的计算,难度较大.

练习册系列答案
相关题目
附加题:车用乙醇汽油是将乙醇(C2H5OH)与汽油(以C8H18表示)按一定比例混合而成的一种汽车燃料.
(1)乙醇分子中,组成元素的原子个数比C:H:O为 .
(2)在密闭容器中,将少量乙醇置于一定量氧气中燃烧,生成二氧化碳、水蒸气和一种未知物质W.现测得反应前后各物质的质量如下:
①根据质量守恒定律,得出表中x的值为 ;
②根据表中数据,可确定未知物W中各组成元素的质量比为 ;
(3)通常可燃物中碳元素质量分数越高,燃烧产生W越多.则相同条件下,乙醇和汽油分别燃烧时,产生W较多的是 ;为了使乙醇汽油燃烧过程中少产生W,应采取的措施是(任写一种) .
(1)乙醇分子中,组成元素的原子个数比C:H:O为
(2)在密闭容器中,将少量乙醇置于一定量氧气中燃烧,生成二氧化碳、水蒸气和一种未知物质W.现测得反应前后各物质的质量如下:
| 物质 | 乙醇 | 氧气 | 二氧化碳 | 水蒸气 | W |
| 反应前质量/g | 23 | 40 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 22 | 27 | x |
②根据表中数据,可确定未知物W中各组成元素的质量比为
(3)通常可燃物中碳元素质量分数越高,燃烧产生W越多.则相同条件下,乙醇和汽油分别燃烧时,产生W较多的是
附加题:车用乙醇汽油是将乙醇(C2H5OH)与汽油(以C8H18表示)按一定比例混合而成的一种汽车燃料.
(1)乙醇分子中,组成元素的原子个数比C:H:O为________.
(2)在密闭容器中,将少量乙醇置于一定量氧气中燃烧,生成二氧化碳、水蒸气和一种未知物质W.现测得反应前后各物质的质量如下:
| 物质 | 乙醇 | 氧气 | 二氧化碳 | 水蒸气 | W |
| 反应前质量/g | 23 | 40 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 22 | 27 | x |
②根据表中数据,可确定未知物W中各组成元素的质量比为________;
(3)通常可燃物中碳元素质量分数越高,燃烧产生W越多.则相同条件下,乙醇和汽油分别燃烧时,产生W较多的是________;为了使乙醇汽油燃烧过程中少产生W,应采取的措施是(任写一种)________.