题目内容
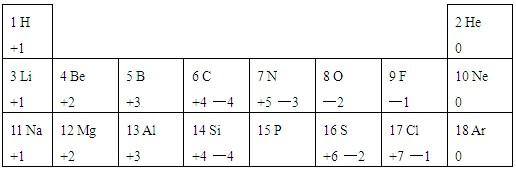
我们周围的物质世界是由100多种元素组成的,为了便于研究元素的性质,常常需要寻找它们之间的内在规律.表1列出的是1~18号元素的部分最高正化合价和最低负化合价,请你阅读后回答下列问题:| 1H +1 | 2He | ||||||
| 3Li +1 | 4Be +2 | 5B +3 | 6C +4,-4 | 7N +5,-3 | 8O -2 | 9F -1 | 10Ne |
| 11Na +1 | 12Mg +2 | 13Al +3 | 14Si +4,-4 | 15P | 16S +6,-2 | 17Cl +7,-1 | 18Ar |
(2)16号元素属于______(填“金属”、“非金属”或“稀有气体”)元素,与该元素化学性质相似的另一元素是______. 推测该元素的最低负化合价为______,最高正化合价的氧化物的化学式为______.
(3)表中不同元素间最本质的区别是______.
(4)表中第三横行开头元素和靠近尾部元素的原子结构示意图分别为
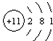 和
和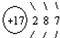 ,它们的单质易发生如图所示的变化
,它们的单质易发生如图所示的变化
根据以上的信息,写出这两种元素形成的化合物的化学式为______.
【答案】分析:(1)根据表中原子序数为9的元素的信息、核外电子在化学反应中的作用进行分析解答.
(2)根据表中原子序数为16的元素的信息、核外电子在化学反应中的作用、化学式的书写方法等进行分析解答.
(3)不同种元素最本质的区别是质子数不同,元素的种类由质子数决定.
(4)根据表中新信息和第三横行开头元素和靠近尾部元素的原子结构示意图,确定11号和17号元素的名称及元素的化合价,根据化学式的写法写出化学式即可.
解答:解:(1)原子序数在数值上等于核电荷数,从元素周期表中可查出核电荷数为9的元素符号F,元素名称是氟,是非金属元素,在化学反应中非金属元素的原子比较容易得到电子形成8个电子的稳定结构.
(2)从元素周期表中可查出核电荷数为16的元素符号S,元素名称是硫,是非金属元素.
根据决定元素化学性质的是原子结构中的最外层电子数,和硫相似的另一元素的原子最外层电子数应相同;硫元素与氧元素最低负化合价相同,它们原子的最外层电子数相同,化学性质相似.
根据表中数据,硫元素的最低负化合价为-2,最高正化合价为+6价,氧元素的化合价为-2价,根据正价先,负价后,形成氧化物的化学式为SO3.
(3)根据不同种元素最本质的区别是质子数不同,元素的种类由质子数决定,可知表中不同元素间最本质的区别是质子数不同.
(4)根据表中第三横行开头元素和靠近尾部元素的原子结构示意图结合表1,可知11号元素为钠元素,17号元素为氯元素;在化学反应中,钠元素的原子比较容易失去最外层的1个电子,从而带上1个单位的正电荷,故钠元素的化合价为+1价;氯元素的原子比较容易得到1个电子,从而带上1个单位的负电荷,故氯元素的化合价为-1价.根据正价先,负价后,这两种元素形成的化合物的化学式为NaCl.
故答案为:
(1)氟;得;
(2)非金属;氧;-2;SO3;
(3)质子数不同;
(4)NaCl.
点评:本题有一定难度,考查同学们新信息获取、理解及灵活运用所学知识(元素概念、元素符号、核外电子在化学反应中的作用、化学式的书写等)进行分析解题的能力.
(2)根据表中原子序数为16的元素的信息、核外电子在化学反应中的作用、化学式的书写方法等进行分析解答.
(3)不同种元素最本质的区别是质子数不同,元素的种类由质子数决定.
(4)根据表中新信息和第三横行开头元素和靠近尾部元素的原子结构示意图,确定11号和17号元素的名称及元素的化合价,根据化学式的写法写出化学式即可.
解答:解:(1)原子序数在数值上等于核电荷数,从元素周期表中可查出核电荷数为9的元素符号F,元素名称是氟,是非金属元素,在化学反应中非金属元素的原子比较容易得到电子形成8个电子的稳定结构.
(2)从元素周期表中可查出核电荷数为16的元素符号S,元素名称是硫,是非金属元素.
根据决定元素化学性质的是原子结构中的最外层电子数,和硫相似的另一元素的原子最外层电子数应相同;硫元素与氧元素最低负化合价相同,它们原子的最外层电子数相同,化学性质相似.
根据表中数据,硫元素的最低负化合价为-2,最高正化合价为+6价,氧元素的化合价为-2价,根据正价先,负价后,形成氧化物的化学式为SO3.
(3)根据不同种元素最本质的区别是质子数不同,元素的种类由质子数决定,可知表中不同元素间最本质的区别是质子数不同.
(4)根据表中第三横行开头元素和靠近尾部元素的原子结构示意图结合表1,可知11号元素为钠元素,17号元素为氯元素;在化学反应中,钠元素的原子比较容易失去最外层的1个电子,从而带上1个单位的正电荷,故钠元素的化合价为+1价;氯元素的原子比较容易得到1个电子,从而带上1个单位的负电荷,故氯元素的化合价为-1价.根据正价先,负价后,这两种元素形成的化合物的化学式为NaCl.
故答案为:
(1)氟;得;
(2)非金属;氧;-2;SO3;
(3)质子数不同;
(4)NaCl.
点评:本题有一定难度,考查同学们新信息获取、理解及灵活运用所学知识(元素概念、元素符号、核外电子在化学反应中的作用、化学式的书写等)进行分析解题的能力.

练习册系列答案
相关题目
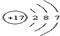 和
和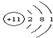 ,它们的单质易发生如图所示的变化
,它们的单质易发生如图所示的变化