题目内容
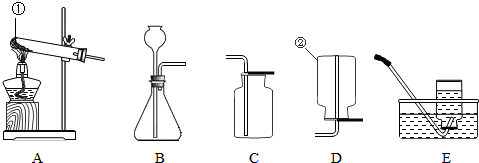
化学是一门以实验为基础的科学,化学所取得的丰硕成果,是与实验的重要作用分不开的.结合下列实验装置图回答问题:
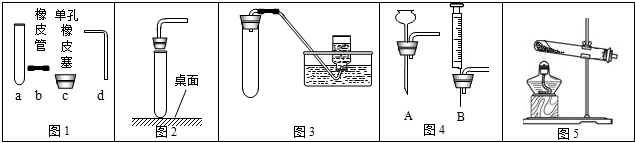
(1)写出指定仪器的名称:①
(2)用高锰酸钾为原料制取氧气化学方程式为
该反应属于基本反应类型的
为了收集较纯净的氧气可选用收集装置是
(3)实验室制取二氧化碳,所选择的制取装置组合是
(4)硫化氢气体是一种无色有臭鸡蛋气味的气体,有剧毒,易溶于水,密度比空气大.实验室可用硫化亚铁固体和稀硫酸溶液在常温下直接反应而制得,则可选用的发生装置是

(1)写出指定仪器的名称:①
试管
试管
②集气瓶
集气瓶
.(2)用高锰酸钾为原料制取氧气化学方程式为
2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
,
| ||
该反应属于基本反应类型的
分解
分解
反应.选择的发生装置是A
A
(填字母代号,下同)在装入药品之前,首先要检查装置的气密性
检查装置的气密性
.为了收集较纯净的氧气可选用收集装置是
E
E
,结果发现水槽中的水变成了紫色,原因是试管口未放棉花
试管口未放棉花
.(3)实验室制取二氧化碳,所选择的制取装置组合是
BC
BC
.检验气体是否收集满的方法是将燃着的木条放于集气瓶口,若木条熄灭,说明收集满了
将燃着的木条放于集气瓶口,若木条熄灭,说明收集满了
.(4)硫化氢气体是一种无色有臭鸡蛋气味的气体,有剧毒,易溶于水,密度比空气大.实验室可用硫化亚铁固体和稀硫酸溶液在常温下直接反应而制得,则可选用的发生装置是
B
B
,收集装置是C
C
.你认为用该收集方法有
有
(填“有”或“没有”)缺陷,理由是氯化氢气体有剧毒,未进行尾气处理
氯化氢气体有剧毒,未进行尾气处理
.分析:(1)据常用仪器回答;
(2)根据反应物和反应条件写出反应方程式;并据反应类型分析反应类型,据反应物状态和反应条件选择发生装置,加入药品前要检查装置的气密性,防止装置漏气;排水法收集可使气体更加纯净,试管口未放棉花,使高锰酸钾进入水槽中让水变色;
(3)据实验室制取二氧化碳的反应条件和反应物的状态选择发生装置,据二氧化碳的密度和溶解性选择收集装置;检验二氧化碳是否收集满可将燃着的木条放于集气瓶口观察木条是否熄灭进行判断;
(4)硫化氢气体可用硫化亚铁固体和稀硫酸溶液在常温下直接反应而制得,据此选择反应装置;根据密度比空气大选择收集装置;根据有剧毒判断收集装置的合理与否.
(2)根据反应物和反应条件写出反应方程式;并据反应类型分析反应类型,据反应物状态和反应条件选择发生装置,加入药品前要检查装置的气密性,防止装置漏气;排水法收集可使气体更加纯净,试管口未放棉花,使高锰酸钾进入水槽中让水变色;
(3)据实验室制取二氧化碳的反应条件和反应物的状态选择发生装置,据二氧化碳的密度和溶解性选择收集装置;检验二氧化碳是否收集满可将燃着的木条放于集气瓶口观察木条是否熄灭进行判断;
(4)硫化氢气体可用硫化亚铁固体和稀硫酸溶液在常温下直接反应而制得,据此选择反应装置;根据密度比空气大选择收集装置;根据有剧毒判断收集装置的合理与否.
解答:解:(1)熟悉常用化学仪器,了解它们的名称.①②名称分别为:试管、集气瓶;
(2)根据反应物和反应条件,可写出反应式:2KMnO4
K2MnO4+MnO2+O2↑;该反应由一种物质生成三种物质,属于分解反应;属于固体加热型,故选发生装置A,加入药品前要检查装置的气密性,防止装置漏气;排水法收集可使气体更加纯净,氧气不易溶于水,故可用排水法收集较纯净的氧气;水槽中水变色,是因为试管口未放棉花,大量的氧气往外排出时带动了一些高锰酸钾沿着导管进入了水槽,所以水槽中的水变成了紫红色;
(3)实验室制取二氧化碳用大理石和稀盐酸常温反应,属于固液常温型,故选发生装置B,二氧化碳的密度比空气大且能溶于水,所以用向上排空气法收集;检验二氧化碳是否收集满可将燃着的木条放于集气瓶口观察木条是否熄灭进行判断;
(4)硫化氢气体可用硫化亚铁固体和稀硫酸溶液在常温下直接反应而制得,适合固体和液体在常温下反应的装置是B;硫化氢气体的密度大于空气的密度,可选用图示中的C装置收集,也就是向上排空气法.但这种方法容易使收集的气体逸出,又因硫化氢有剧毒,可能使人中毒,所以此装置不合理;
故答案为:(1)试管;集气瓶;
(2)2KMnO4
K2MnO4+MnO2+O2↑;分解;A;检查装置的气密性;E;试管口未放棉花;
(3)BC;将燃着的木条放于集气瓶口,若木条熄灭,说明收集满了;
(4)B;C;氯化氢气体有剧毒,未进行尾气处理.
(2)根据反应物和反应条件,可写出反应式:2KMnO4
| ||
(3)实验室制取二氧化碳用大理石和稀盐酸常温反应,属于固液常温型,故选发生装置B,二氧化碳的密度比空气大且能溶于水,所以用向上排空气法收集;检验二氧化碳是否收集满可将燃着的木条放于集气瓶口观察木条是否熄灭进行判断;
(4)硫化氢气体可用硫化亚铁固体和稀硫酸溶液在常温下直接反应而制得,适合固体和液体在常温下反应的装置是B;硫化氢气体的密度大于空气的密度,可选用图示中的C装置收集,也就是向上排空气法.但这种方法容易使收集的气体逸出,又因硫化氢有剧毒,可能使人中毒,所以此装置不合理;
故答案为:(1)试管;集气瓶;
(2)2KMnO4
| ||
(3)BC;将燃着的木条放于集气瓶口,若木条熄灭,说明收集满了;
(4)B;C;氯化氢气体有剧毒,未进行尾气处理.
点评:本题考查实验装置的连接、装置的合理性与否,使学生明白实验装置合理的重要性,考查了学生应用知识解决问题的能力.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
 20、化学是一门以实验为基础的科学,规范的实验操作是实验成功的前提,请回答:
20、化学是一门以实验为基础的科学,规范的实验操作是实验成功的前提,请回答: