题目内容
【题目】空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应。下图是以空气和其他必要的原料合成氮肥(NH4NO3)的工业流程。请按要求回答下列问题:
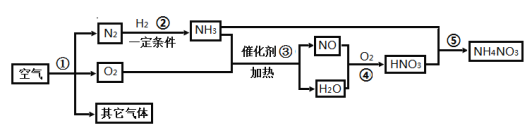
(1)步骤①中发生的是_____________变化(填“物理”或“化学”)。
(2)上述化学反应中属于化合反应的有_____________个。
(3)写出步骤③中发生反应的化学方程式________________________。

(4)根据如图部分说明:硝酸铵应具有的性质是__________(填字母)。
A.易溶于水 B.有挥发性 C.受热易分解
(5)根据硝酸铵的化学式计算:硝酸铵中氮元素的质量分数为___________。
(6)根据右图标签计算:该化肥中硝酸铵的质量分数至少是___________。(结果保留至0.1%)
【答案】(1)物理;(2)3;
(3)4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(4)AC;(5)35%;(6)85.7%
【解析】
试题分析:(1)步骤①是将空气加压、降温液化,然后再升温,据空气中各成分的沸点不同,可先后挥发而
分离,没有新的物质生成,所以是物理变化;如果有新物质生成的变化,则属于化学变化;所共有3个化学变化,(3)写出步骤③中发生反应的化学方程式 4NH3 + 5O2 ![]() 4NO + 6H2O;由题中信息“密封储存、防潮防晒、隔绝热源”可知硝酸铵易溶于水、受热易分解;(5)相对分子质量=(相对原子质量×原子个数)之和,硝酸铵的相对分子质量为80,
4NO + 6H2O;由题中信息“密封储存、防潮防晒、隔绝热源”可知硝酸铵易溶于水、受热易分解;(5)相对分子质量=(相对原子质量×原子个数)之和,硝酸铵的相对分子质量为80,![]() 硝酸铵中氮元素的质量分,28÷80×100%=35%(6)化肥中硝酸铵的质量分数至少为:30%÷35%×100%= 85.7%
硝酸铵中氮元素的质量分,28÷80×100%=35%(6)化肥中硝酸铵的质量分数至少为:30%÷35%×100%= 85.7%

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目